1、选择题 下列叙述正确的是
A.液态氯化氢和固态氯化钠均不导电,所以氯化氢和氯化钠均为非电解质
B.CO2、NH3的水溶液导电,所以它们是电解质
C.铜丝和石墨均导电,所以它们是电解质
D.蔗糖和酒精在水溶液和熔融状态均不导电,所以它们均为非电解质
参考答案:D
本题解析:电解质不是在所有状态下都能导电,只要在水溶液或熔融状态能电离的化合物都是电解质,在上述情况下不能电离的化合物为非电解质,故选项A错误,选项D正确.电解质是溶于水或熔融状态能电离成自由移动的离子的化合物.选项B中CO2、NH3溶液能导电是因为它们溶于水生成的一水合氨和碳酸能电离出自由移动的离子所致,CO2、NH3本身不是电解质,是非电解质;NH3·H2O、H2CO3是电解质,选项B错误.电解质和非电解质都是化合物,故选项C错误.
本题难度:困难
2、选择题 下列溶液中酸性最强的是
A.pH=4.5
B.C(H+)=10-4 mol·L-1
C.C(OH-)=1×10-8 mol·L-1
D.加入甲基橙变红的溶液
参考答案:D
本题解析:根据pH定义,B项pH=4,C项pH=6,D项变色范围pH在3.1以下,故选D项。
本题难度:一般
3、选择题 下列物质中能导电的电解质是( )
A.SO2
B.盐酸
C.铁
D.熔融的氯化钠
参考答案:A.二氧化硫是非电解质,故A错误;
B.盐酸是混合物,既不是电解质也不是非电解质,故C错误;
C.铁是单质,既不是电解质也不是非电解质,故C错误;
D.氯化钠是电解质,且熔融态氯化钠中含有自由移动的阴阳离子,所以能导电,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.碳酸氢钠与盐酸反应:CO3-+2H+=H2O+CO2↑
C.醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
D.过量的二氧化碳通入澄清的石灰水中:CO2+Ca2++2OH-=CaCO3↓+H2O
参考答案:C
本题解析:分析:A、离子方程式电荷不守恒;
B、碳酸氢根离子是弱酸的酸式酸根,不能拆成离子;
C、醋酸是弱酸,酸性大于碳酸,反应生成二氧化碳气体;
D、过量的二氧化碳通入澄清的石灰水中反应生成碳酸氢钙.
解答:A、钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B、碳酸氢钠与盐酸反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故B错误;
C、醋酸溶液与氢氧化钠溶液反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,故C正确;
D、过量的二氧化碳通入澄清的石灰水中反应生成碳酸氢钙,反应的离子方程式:2CO2+Ca2++2OH-=Ca2++2HCO3-,故D错误;
故选C.
点评:本题考查了离子方程式书写方法和注意问题,主要是离子方程式的电荷守恒,弱电解质的判断,量不同产物不同,题目难度中等.
本题难度:简单
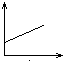
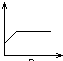
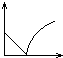
5、选择题 向澄清石灰水中不断通入二氧化碳气体的过程中,该溶液的导电性的变化是(纵坐标表示导电性,横坐标表示二氧化碳气体的物质的量)( )
A.
B.
C.
D.
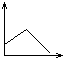
参考答案:C
本题解析:
本题难度:一般