1、选择题 室温下0. 1mol/L的NH4CN溶液的pH等于9.32,据此,在室温下,下列说法错误的是
[? ]
A.上述溶液能使甲基橙试剂变黄色
B.室温下,NH3·H2O是比HCN更弱的电解质
C.上述溶液中CN-的水解程度大于NH4+的水解程度
D.室温下,0.1mol/L NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度
2、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
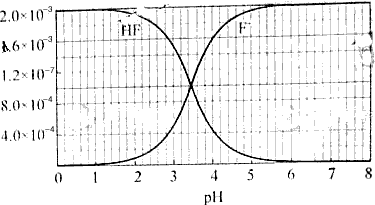 ?
? 
?图2
请根据以下信息回答下旬问题:
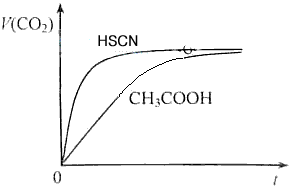
(1)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ___________________________________________________________________________________________________________,
②反应结束后所得两溶液中,c(CH3COO-)_______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ ,列式并说明得出该常数的理由 ________________________________________________________________________________________________________。
(3)4.0×10-3 mol/LHF溶液与4.0×10-4 mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
3、选择题 下列物质属于强电解质的是
A.NH3·H2O
B.H2O
C.CH3COOH
D.醋酸铵
4、选择题 25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是

[? ]
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中 c(Na+)>c(CN-),则a一定大于b C.0.1 mol·L-1 CH3COOH逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
5、选择题 以碳棒作电极,以同等强度的电流同时电解下列体积相同的溶液,最先终止反应的是
A.0.1 mol/L H2SO4
B.0.4 mol/L NaOH
C.0.3 mol/L KNO3
D.0.5 mol/L HCl