1、选择题 下列有关金属腐蚀与防护的说法正确的是
[? ]
A.在海轮外壳连接锌块可以保护外壳不受腐蚀
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.纯银器表面在空气中主要因电化学腐蚀渐渐变暗
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀?
参考答案:A
本题解析:
本题难度:简单
2、填空题 下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
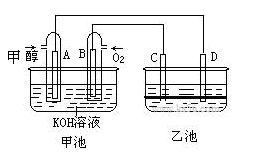
(1)通入甲醇的惰性电极的电极反应式为?。若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为?。
(2)在乙池反应过程中,可以观察到?电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色, C极发生的电极反应式为?。
参考答案:(1)CH3OH+80H--6e-=CO32-+6H2O、4OH--4e-=2H2O+O2↑
(2)C?2I--2e-=I2
本题解析:(1)根据装置的构造可知,甲装置是原电池,乙是电解池。甲醇在反应中失去电子,所以通入甲醇的电极是负极,其电极反应式为CH3OH+80H--6e-=CO32-+6H2O。充电时A接电源的负极,B接电源的正极,溶液中的OH-放电,所以此时B极发生的电极反应式为4OH--4e-=2H2O+O2↑。
(2)溶液呈现棕褐色,且反应完毕后,用玻璃棒搅拌溶液,下层溶液呈现紫红色,上层接近无色,所以该溶液是碘化钠溶液。碘离子在阳极失去电子生成单质碘,C电极和正极相连,做阳极,所以C电极周围的溶液呈现棕褐色,电极反应是2I--2e-=I2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,主要是考查学生对电化学原理的熟悉了解程度,有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池和电解池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
3、选择题 下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
参考答案:A.发生电化学腐蚀时,金属应不纯,则纯银器主要发生化学腐蚀,故A正确;
B.铁比锡活泼,当镀锡铁制品的镀层破损时,铁易被腐蚀,故B错误;
C.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故C正确;
D.防止金属被氧化,金属应连接电源的负极,如连接正极,加剧腐蚀,故D错误.
故选AC.
本题解析:
本题难度:简单
4、选择题 某化学探究性学习小组在探究溶液导电性的实验中发现:往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,而向盐酸溶液中加入少量氢氧化钠固体灯泡的明亮程度没明显变化,他们由此得到了如下一些结论,其中合理的是?(?)
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子的种类有关
C.溶液的导电性与溶液中离子的种类和数目有关
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
参考答案:A
本题解析:
正确答案:A
溶液的导电性与溶液中离子的浓度和离子所带电荷有关,A、正确;B、C不妥当;D,加盐酸没有离子浓度明显减少的过程。
本题难度:简单
5、填空题 烧过菜的铁锅未及时洗去含有NaCl的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为Fe(OH)3失水的产物。铁锅的锈蚀主要属于?(填“析氢”或“吸氧”)腐蚀。
(1)请你表示此时Fe被腐蚀的电极反应式:负极?,正极 ?.
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式?
(3)发生原电池反应生成Fe(OH)2的总反应式为?
(4)Fe(OH)2与O2和水反应转化为Fe(OH)3,然后进一步转化为铁锈的化学方程式:?
?。
参考答案:吸氧? (1) 2Fe→2Fe2++4e-? 2H2O+O2+4e-→4OH-
(2)Fe2++2OH-=Fe(OH)2↓?(3)2Fe+2H2O+O2=2Fe(OH)2
(4)4Fe(OH)2+2H2O+O2=4Fe(OH)3?2Fe(OH)3=Fe2O3.xH2O+(3-x)H2O
本题解析:金属腐蚀分为化学腐蚀和电化学腐蚀,其中以电化学腐蚀为主。在电化学腐蚀中又以吸氧腐蚀为主。
(1)Fe被腐蚀时负极是铁失去电子,正极是氧气得到电子,电极反应式分别是负极:2Fe→2Fe2++4e-,正极:2H2O+O2+4e-→4OH-。
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式是Fe2++2OH-=Fe(OH)2↓。
(3)根据以上分析可知,发生原电池反应生成Fe(OH)2的总反应式为2Fe+2H2O+O2=2Fe(OH)2。
(4)氢氧化亚铁不稳定,极易被氧化生成氢氧化铁。氢氧化铁失去水,即变成铁锈,即反应的方程式分别是4Fe(OH)2+2H2O+O2=4Fe(OH)3、2Fe(OH)3=Fe2O3.xH2O+(3-x)H2O
点评:该题是基础性试题的考查,难度不大。主要是考查学生对金属腐蚀的了解掌握程度,有利于调动学生的学习兴趣,提高学生应试能力和学习效率。
本题难度:一般