1、选择题 下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是(?)
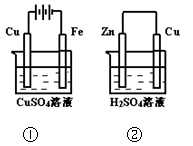
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上生成物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑
D.溶液的pH:①不变;②增大
2、选择题 制印刷电路板时常用氯化铁溶液作为“腐蚀液”,其反应的化学方程式为Cu+2FeCl3=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁
B.烧杯中铁、铜都无
C.烧杯中铜、铁都有
D.烧杯中有铁无铜
3、选择题 下列说法正确的是(? )
A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同
B.粗铜精炼时,与电源负极相连的是粗铜
C.船底镶嵌锌块,锌作负极,以防船体被腐蚀
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源
4、选择题 关于下列各装置图的叙述中,不正确的是?(?)
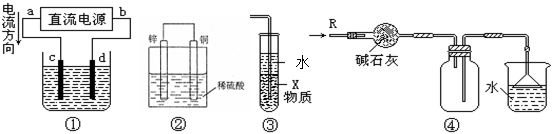
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
5、填空题 甲、乙两池的电极材料如图所示,请按要求回答下列问题:
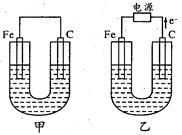
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的?(填“铁”或“碳”)棒;乙池中的?(填
“阴”或“阳”)极。
②乙池中阳极上发生的电极反应方程式是?。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式:?。
②甲池中碳极上电极反应方程式是?,乙池碳极上
电极反应属于?(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现
蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的C12和I2物质的量
之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为?。
④若乙池中转移0.1 mol e-后停止实验,池中溶液体积是1L,则溶液混匀后的pH=?(不考虑所生成的气体溶解在溶液中的情况)