1、填空题 (1)如图,若烧瓶是干燥的.当烧瓶口向上时,由A口导入气体,可收集下列中的______(填序号,下同)气体.若烧瓶充满水,可收集下列中的______气体.①NO ②NH3 ③SO2 ④NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是______.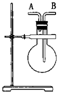
参考答案:(1)由A口导入气体,用该装置收集气体的依据,由于是集气瓶口向上,所以能够收集的气体密度必须小于空气且不能和空气的成分反应,而密度小于空气且不能和空气的成分反应的气体只有NH3;若烧瓶充满水,该装置收集气体的依据是能够不溶于水或与水不反应的气体,而不溶于水或与水不反应的气体只有NO,故答案为:②;①;
(2)此时该装置收集气体的依据类似于排空法收集气体,从A 口进,能够收集的气体密度必须大于氨气且不能和氨气反应,从B口进,能够收集的气体密度必须小于氨气且不能和氨气反应,故答案为:A;NH3的密度小于NO.
本题解析:
本题难度:一般
2、填空题 某同学用10mol·L—1的浓盐酸配制250mL 1 mol·L—1的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸?mL。(2分)
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
?等。(2分)
(3)取所配制的稀盐酸100mL与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为多少克?(写出计算过程)(3分)
(4)设反应后溶液的体积仍为100mL,则反应后溶液中H+物质的量浓度是多少?(写出计算过程)(3分)
参考答案:(1) 25mL?(2分)
(2)250ml容量瓶 胶头滴管?(2分)
(3)2.6g?(3分)
(4)0.2 mol·L—1(3分)
本题解析:略
本题难度:简单
3、填空题 实验室欲用NaNO3固体配制80 mL 1.4 mol·L-1的NaNO3溶液,试回答:
(1)用不到的仪器是__________;
A.烧杯?B.500 mL容量瓶? C.量筒?
D.胶头滴管? E.玻璃棒? F.100 mL容量瓶
(2)配制时应称取NaNO3__________g;
(3)实验开始时,需检查容量瓶__________;
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配溶液浓度无影响的是(写字母) __________;会使所配溶液浓度偏大的是__________;会使所配溶液浓度偏小的是__________。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.容量瓶中所配的溶液液面未到刻度线便停止加水
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.容量瓶中液面将达到刻度线时,俯视刻度线和液面
参考答案:(1) B? (2) 11.9? (3) 是否漏水? (4) D、E? C、F? A、B
本题解析:(1)由于没有80ml的容量瓶,所以应该配制100ml,则不需要的仪器是500ml容量瓶,答案选B。
(2)配制时应称取硝酸钠固体的质量是0.1L×1.4mol/L×85g/mol=11.9g。
(3)实验开始时,需检查容量瓶是否漏水。
(4)根据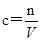 可知,在烧杯中溶解溶质,搅拌时不慎溅出少量溶液,则溶质的质量减少,浓度偏低;未将洗涤烧杯内壁的溶液转移入容量瓶,同样是溶质质量减少,浓度偏低;容量瓶中所配的溶液液面未到刻度线便停止加水,则容量瓶中溶液体积减少,浓度偏高;将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出,浓度不变;将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,不会影响实验结果;容量瓶中液面将达到刻度线时,俯视刻度线和液面,则容量瓶中溶液体积减少,浓度偏高。
可知,在烧杯中溶解溶质,搅拌时不慎溅出少量溶液,则溶质的质量减少,浓度偏低;未将洗涤烧杯内壁的溶液转移入容量瓶,同样是溶质质量减少,浓度偏低;容量瓶中所配的溶液液面未到刻度线便停止加水,则容量瓶中溶液体积减少,浓度偏高;将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出,浓度不变;将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,不会影响实验结果;容量瓶中液面将达到刻度线时,俯视刻度线和液面,则容量瓶中溶液体积减少,浓度偏高。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题的难点是误差分析,根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此判断。
本题难度:一般
4、实验题 (每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品?(填字母编号)
B、0.5L平底烧瓶? C、0.5L容量瓶? D、0.5L圆底烧瓶? E、烧杯? F、试管? G、胶头滴管? H、量筒? I、托盘天平? J、药匙? M、滤纸? N、玻璃棒
(2)应称取?g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入?(酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=?
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温 度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
参考答案:(每空2分 ,?共14分)
(一)(1)CHENG?(2)10.6
(二)(1)碱式?黄色变成橙色30s不褪去
(2)0.5mol/L
(三)- 57.0 KJ/mol?偏高
本题解析:略
本题难度:简单
5、选择题 通常情况下能共存,且能用浓硫酸干燥的一组气体是
A.H2 O2 N2
B.O2 NO NO2
C.H2 N2 NH3
D.NH3 HCl NO2
参考答案:A
本题解析:浓硫酸具有酸性和氧化性,所以不能干燥碱性气体和还原气体,A正确,B、D中气体不能大量共存,C中氨气不能用浓硫酸干燥,答案选A。
本题难度:简单