1、实验题 (16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液 、? 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是?(只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要?(填仪器名称);若定容时仰视刻度线,则所配溶液的浓度?(填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为?,同样条件下收集的Cl2?(填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为:?;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置?(填代号)
可选用制备气体的装置:

所选装置中的两个洗气瓶里应依次盛装?、?(填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由?;尾气用?溶液(填化学式)吸收,写出发生反应的离子方程式?。
2、填空题 (12分)已知固体草酸(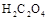 )分解的化学方程式为:
)分解的化学方程式为:
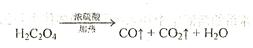
某实验小组为测定铁锈样品的组成(假定铁锈中只有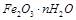 和
和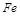 两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
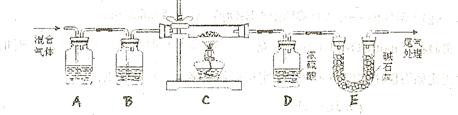
(1)为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次是?、?(填答案编号)a.浓硫酸? b.澄清的石灰水? c.氢氧化钠溶液? d.氯化钙溶液
(2)在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;
(b)??;
(3)E装置的作用是?。
上述装置最后尾气处理的方法是?:
(4)准确称量样品质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=?.
(5)在本实验中,下列情况会使测定结果n偏大的是?(填答案编号)
a.缺少装置B? b.缺少装置E? c.反应后的固体剩余少量
3、实验题 现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2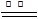 2MgO;②3Mg+N2
2MgO;②3Mg+N2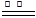 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2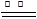 2MgO+C;
2MgO+C;
④Mg+H2O MgO+H2↑; ⑤Mg3N2 +6H2O
MgO+H2↑; ⑤Mg3N2 +6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题:
(1)在设计实验方案时,除装置A、D、E外,还应选择的装置有?(填字母代号),选择装置D目的为_____________________________?;
(2)通气后,应先点燃?处的酒精灯;如果同时点燃A、F装置的酒精灯,将会使实验结果?(填“偏高”或“偏低”)原因?
(3)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:
_____________________________________________________________________?
4、实验题 (10分)实验室制取乙酸乙酯的主要步骤如下:
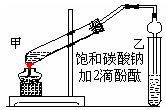
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
D.加速酯的生成,提高其产率。