|
高考化学知识点总结《气体的净化、干燥、吸收与收集》考点预测(2019年强化版)(六)
2019-06-28 21:17:41
【 大 中 小】
|
1、实验题 配制500mL 1.0mol·L—1的NaOH溶液时,下列哪些操作会使实验结果偏高_____________;偏低__________;无影响______________。
A.称量时,直接把氢氧化钠放在纸上称量,且称量时间过长
B.称量时,固体放在右盘,砝码放在左盘
C.称量时所用砝码生锈
D.原容量瓶用蒸馏水洗净后未干燥
| E . 移液后,未洗涤烧杯和玻璃棒
F. 定容时,俯视刻度线
G. 颠倒摇匀溶液后,发现液面低于刻度线,再补加水到刻度线
H. 溶液尚未冷却到室温就注入容量瓶进行定容
参考答案:偏高(CFH)偏低(ABEG)无影响(D)
本题解析:略
本题难度:简单
2、实验题 (16分)欲用98 %的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题: %的浓硫酸(ρ= 1.84g/cm3)配制浓度为0.5 mol/L的稀硫酸500mL。有以下几步操作,请按要求回答下列问题:
A.用量筒量取浓硫酸?
B.反复上下颠倒摇匀
C.加蒸馏水至刻度线下1~2cm时改用胶头滴管加水至刻度线
D.洗净所用仪器?
E.稀释浓硫酸
F.将稀释后并冷却的硫酸溶液注入容量瓶
G.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也注入容量瓶?
(1)其操作正确的顺序为(填编号):?。
① D A E F G B C?② D A E F G C B?③ D A F E G B C
(2)简要回答下列问题:
①所需浓硫酸的体积为??mL(小数点后保留一位)。现有10mL 、15mL、20mL、50mL四种量筒,应选用?mL的量筒最好。
②洗涤烧杯2~3次,洗涤液也要转入容量瓶,否则会使结果浓度?。(填偏高,偏低或无影响)
③稀释后并冷却的硫酸用?注入?中。
④加蒸馏水定容时必须使溶液凹液面与容量瓶刻度线相切,如果不小心将水加过刻度线应? ?。 ?。
(3)下列实验操作,造成溶液浓度偏低的是?。
A.容量瓶用蒸馏水洗净后未经干燥处理
B.转移过程中有少量溶液溅出
C.稀释后的硫酸没有冷却到室温就转移到容量瓶中并加水定容
D.定容时,俯视容量瓶的刻度线
E.摇匀后发现液面低于刻度线,再用胶头滴管加水至刻度线
参考答案:(16分)?
(1) ②
(2) ①? 13.6? 15 ②?偏低③玻璃棒引流? 500mL容量瓶 (不写容积扣1分)④?重新配制
(3)BE
本题解析:略
本题难度:简单
3、选择题 实验室为了制取干燥的氨气,下列方法中适合的是(?)
A.NH4Cl和H2SO4(浓)混合加热,生成的气体用碱石灰干燥
B.N2 + H2→ NH3,用烧碱干燥
C.氯化铵和氢氧化钙固体混合加热,气体用碱石灰干燥
D.向浓氨水中加入生石灰,气体用P2O5干燥
参考答案:C
本题解析:
正确答案:C
A、得不到氨气,生成HCl气体;
B、是工业制氨气;
C、正确;
D、不能用酸性干燥剂。
本题难度:简单
4、填空题 (14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:
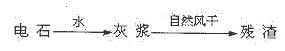
I.残渣中主要成分是Ca(OH)2和?。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是?。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2?升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
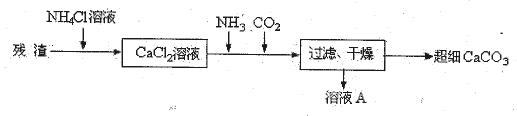
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因?。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是?。
③图示的溶液A可循环使用,其主要成分的化学式是?。
参考答案:(14分)
Ⅰ.CaCO3?(2分)
Ⅱ.6Cl2+6Ca(OH)2 = 5CaCl2+Ca(ClO3)2 + 6H2O?(3分)
Ⅲ.26.88或26.9?(2分)
Ⅳ.① CaCO3(s) Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案)?(2分) Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案)?(2分)
② CaCl2 + 2NH3 + CO2 + H2O ="=" CaCO3↓+ 2NH4Cl?(3分)
③ NH4Cl?(2分)
本题解析:电石与水反应生成乙炔和灰浆:氢氧化钙,氢氧化钙在风干的过程中与二氧化碳反应生成碳酸钙;由6Cl2~ Ca(ClO3)2~2 KClO3
6x22.4? 2x122.5
V? 49? V=" 6x22.4" x49/245=26.88L
Ⅳ: ① CaCO3存在沉淀溶解平衡CaCO3(s) Ca2++CO32-,而NH4Cl溶液水解产生的H+ Ca2++CO32-,而NH4Cl溶液水解产生的H+
与CO32-反应使CO32-浓度减小,平衡向右移动,CaCO3溶解;②生成超细CaCO3与侯氏制碱法原理相同,生成的NH4Cl可循环使用。
本题难度:一般
5、实验题 (10分)下列示意图是实验室中常用于制取气体的装置 ,根据你所掌握的知识回答 ,根据你所掌握的知识回答
下列问题:
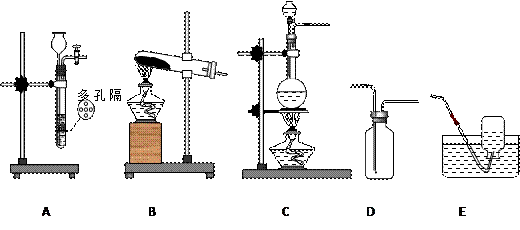
(1)制取下列气体的装置分别是(填字母代号):
氯气___?____、氨气___?___、二氧化碳_____?_、NO___?___
(2)以上气体可以用E装置收集的有(填化学式)______________________
(3)分别写出实验室 制取Cl2和NH3的化学方程式: 制取Cl2和NH3的化学方程式:
Cl2:?
NH3:?
参考答案:(10分)[? (1)题(每空1分),(2)(3)题每空 2分] 2分]
(1) 氯气__ C__、氨气___B__、二氧化碳__A _、NO_ A _或C(微热_
(2)Cl2? NO
(3)MnO2+4HCl(浓)="=" MnCl2+Cl2↑+2H2O
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
本题解析:略
本题难度:一般
|