1、实验题 (15分)镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是?镁原子电子式?
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是?(不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg > Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是?
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④通过观察某种实验现象得到结论,该实验现象是?
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。
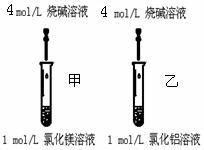
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg > Al”
甲试管现象?
乙试管离子方程式?
实验三:利用原电池原理也可得出“金属性:Mg > Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg >Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
参考答案:
(1)①第三周期第IIIA族? ·Mg·?各1分,共2分?(2)② A、B? 2分,漏选且选对给1分,其它0分
(3)③ A、B? 2分,漏选且选对给1分,其它0分
④溶液中无色气泡产生的快慢或金属溶解的快慢? 2分
⑤溶液中出现白色沉淀? 2分
Al3+ + 4OH—=AlO2—+ 2H2O? 2分
⑥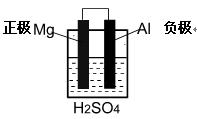 3分?正负极标出给1分
3分?正负极标出给1分
电极材料写出给1分
电解质溶液写出给1分
本题解析:略
本题难度:简单
2、填空题 有A、B、C、D四种元素,A的最高正价与其负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为零;C2-与氩原子具有相同的电子层结构。
(1)试写出上述各元素的符号:
A________,B________,C________,D________。
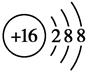
(2)画出下列粒子的结构示意图:
A_________________,C2-_________________。
(3)写出A、D的最高价氧化物对应水化物反应的化学方程式:__________________________________________________________。
参考答案:(1)Cl C S K
(2)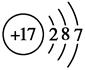
(3)HClO4+KOH=KClO4+H2O
本题解析:因为“A的最高正价与负价的绝对值之差为6”,确定A为氯(Cl);“B有两个电子层,最高正价与最低负价的代数和为0”,确定B为碳(C);C2-的结构示意图为: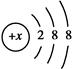 ,确定C为硫(S);再由A推出D为钾(K)。
,确定C为硫(S);再由A推出D为钾(K)。
本题难度:一般
3、选择题 下列说法正确的是
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第3周期元素的离子半径从左到右逐渐减小
参考答案:B
本题解析:A项中同周期的第ⅠA族和第ⅡA族的金属元素比较,第ⅠA族的元素比第ⅡA族的元素的金属性强,但不同周期的是无法比较的,如Ca的金属性比Na的金属性强;B项中同主族元素氢化物的沸点随相对分子质量的增大而升高,但由于氢键的存在,H2O的沸点是该族氢化物中最高的,稳定性也是最好的;C项在比较非金属氧化物对应水化物的酸性时,一定要是最高价含氧酸才可以比较;D项第3周期中原子半径从左到右是逐渐减小的,但在形成离子时Na+、Mg2+、Al3+比其原子少了一个电子层,而S2-、Cl-电子层并不变,仍是3层,所以同周期元素的阴离子半径大于阳离子半径。
本题难度:一般
4、选择题 根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是? (? )
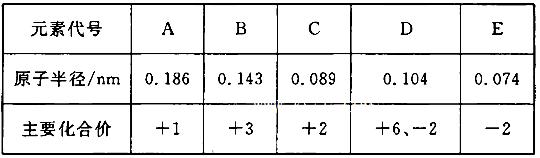
A.E2-与B3+的核外电子数不可能相等
B.离子半径大小A+<E2-
C.最高价氧化物对应水化物的碱性A<C
D.氢化物的稳定性H2D>H2E
参考答案:B
本题解析: 由表中数据可知A为钠,B为铝,C为铍,D为硫,E为氧。A. E2-与B3+的核外电子数都是10,相等,错误。 B.离子半径大小A+<E2-,正确。 C.钠比铝活泼,故最高价氧化物对应水化物的碱性C<A,错误。 D.元素的非金属性越强其对应氢化物的稳定性越稳定,应该是H2E>H2D,错误。
本题难度:一般
5、选择题 下列分子中σ键是以s轨道与sp2杂化轨道“头碰头”方式重叠而成的是(?)
A.C2H2
B.HCl
C.H2O
D.C2H4
参考答案:D
本题解析:A中碳原子是sp杂化,B中不存在杂化轨道,属于s-pσ键;C中氧原子是sp3杂化;D中乙烯是平面型结构,碳原子是sp2杂化,答案选D。
点评:该题是中等难度的试题,试题基础性强,注重对学生基础知识的巩固和训练,旨在培养学生的应试能力,提高学生的学习效率。该题的关键是明确分子的结构特点,然后结合题意灵活运用即可。
本题难度:简单