|
高考化学知识点总结《化学平衡的移动和应用》答题技巧(2019年最新版)(十)
2019-06-28 21:21:28
【 大 中 小】
|
1、选择题 已知反应:3A(g)+B(g)

C(s)+4D(g);△H=-Q?kJ/lmol下列分析错误的是( )
A.在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,则最初加入B的量为0.25mol
B.在恒温下,加入过量的C和1mol的D反应达到平衡后,再加入1molD,同时压强再增大一倍,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍
C.如果在C(s)中含有难熔性的杂质,将其放在下列装置的b点处,并充入一定量的D(g),一段时间后,可在a点处得到纯C(S)
D.当反应向逆反应方向进行时,v逆(B)>3v(A)正
| 
参考答案:A、在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,混合物的起始量一定按照化学方程式中的反应比投料.即1molAB按照3:1组成,A物质的量为0.75mol,B物质的量为0.25mol,故A正确;
B、3A(g)+B(g)

C(s)+4D(g);中C为,固体对平衡无影响,反应前后气体体积不变,加入过量的C和1mol的D反应达到平衡后,A的浓度将增加到原平衡的1倍,再加入1molD相当于增大压强,A的浓度又增大到原来的2倍,压强再增大一倍,平衡不动,相当于体积变为原来的一半,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍,故B正确;
C、利用C中含的杂质是难溶物熔沸点高,把含杂质的C放在高温区,通入D气体,反应是放热反应,高温平衡逆向进行,生成ABD的平衡气体在a点温度降低,平衡正向进行,生成纯净C固体,故C正确;
D、反应的正反应速率之比等于系数之比,v正(A):v正(B)=3:1,当反应向逆反应方向进行时对于B,v正(B)<v逆(B),所以v逆(B)>13v(A)正,故D错误;
故选D.
本题解析:
本题难度:简单
2、选择题 一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:A(g)+3B(g)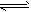 2C(g)经2分钟反应达到平衡,此时生成0.2mol C。 下列说法正确的是 2C(g)经2分钟反应达到平衡,此时生成0.2mol C。 下列说法正确的是
[? ]
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L·min)
B.反应开始至2分钟时,A的转化率为5%
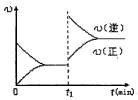
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合上图
参考答案:C
本题解析:
本题难度:一般
3、选择题 某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确的是( )
A.平衡正向移动
B.平衡逆向移动
C.Z的体积分数变大
D.(a+b)>(c+d)
参考答案:持温度不变压强增大至原来的2倍,将容器的容积压缩到原来容积的一半,假定平衡不移动,W浓度变为原来的2倍,达到新平衡时,物质W的浓度是原来的1.8倍,说明平衡向逆反应方向移动,则应由a+b<c+d,
A.由上述分析可知,增大压强平衡向逆反应移动,故A错误;
B.由上述分析可知,增大压强平衡向逆反应移动,故B错误;
C.平衡向逆反应移动,Z的体积分数减小,故C错误;
D.平衡向逆反应方向移动,则应由a+b<c+d,故D错误;
故选B.
本题解析:
本题难度:简单
4、填空题 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图
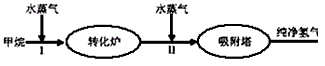
(1)此流程的第II步反应为:CO(g)+H2O(g)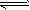 H2(g)+CO2(g),该反应的化学平衡常数表达式为K=___________;反应的平衡常数随温度的变化如表一 H2(g)+CO2(g),该反应的化学平衡常数表达式为K=___________;反应的平衡常数随温度的变化如表一
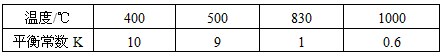
从上表可以推断:此反应是________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mo1,则达到平衡后 CO的转化率为___________。
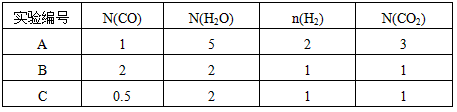
(2)此流程的第II步反应CO(g)+H2O(g)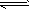 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号) H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是_________
① 体系的压强不再发生变化
② 混合气体的密度不变
③ 混合气体的平均相对分子质量不变
④ 各组分的物质的量浓度不再改变
⑤ 体系的温度不再发生变化
⑥ v(CO2正)=v(H2O逆)
(4)图表示该反应此流程的第II步反应在时刻t 达到平衡、在时刻t分别因改变某个条件而发生变化的情况:图中时刻t 发生改变的条件是_________。(写出两种)
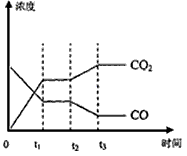
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为___________________。
参考答案:(1)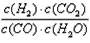 ;放;50%? ;放;50%?
(2)B
(3)④⑤⑥
(4)降低温度或增加水蒸汽的量或减少氢气的量
(5)CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ·mol-1
本题解析:
本题难度:困难
5、填空题 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)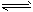 CH3OH(g) 根据题意完成下列各题 CH3OH(g) 根据题意完成下列各题

(1)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________(用nB、tB表示)
(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是__________。
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:____________________(用化学方程式表示)
参考答案:(1)2nB/3tBmol/(L·min)
(2)bc
(3)Cu2O+CO2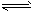 Cu+CO2 Cu+CO2
本题解析:
本题难度:一般
| 