1、填空题 高炉炼铁中发生的基本反应之一如下:FeO(s) +CO(g)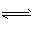 Fe(s)+CO2(g)-Q 其平衡常数可表示为K=
Fe(s)+CO2(g)-Q 其平衡常数可表示为K=
c(CO2)/c(CO),已知1100℃时 K=0. 263.且化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2 和CO的体积比值____,平衡常数K值___。(填 “增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025mol/L,c(CO)= 0.1 mol/L.在这种情况下,该反应是否处于化学平衡状态 _____(填“是”或“否”)。此时,化学反应速率是v正_____v逆 91ExAm.org(填“大于”“小于”或“等于”),其原因是_____________。
2、选择题 在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g)?2c(g)△H1<0;x(g)+3y(g)?2z?(g)△H2>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入z气体,反应器中温度升高
B.等容时,通入z气体,y的物质的量浓度增大
C.等容时,通入惰性气体,各反应速率不变
D.等压时,通入惰性气体,c的物质的量不变
3、填空题 合成氨对工、农业生产和国防都有重要意义。已知:25℃时,N2(g)+3H2(g)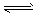 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:
(1)已知:破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。计算1mol
N2 (g) 和3 mol H2 (g) 完全转化为NH3(g)的反应热的理论值___________ 。
(2)对合成氨平衡体系改变以下条件,判断平衡移动方向:
I ①恒容容器中充入氦气,平衡________移动(填“正向”、“逆向”、“不移动”,下同);
②恒容容器中充入氮气,平衡________移动;
③恒容容器中充入氨气,平衡________移动;
II 恒压容器内充入氦气,平衡________移动。
(3)在密闭容器中,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________ 。
a 平衡不发生移动
b 平衡向正反应方向移动
c 平衡向逆反应方向移动
d.NH3的质量分数增加
e 正、逆反应速率都增大
(4)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
① 20 MPa -5 0 MPa
②500℃的高温
③铁触媒作催化剂
④ 将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
4、填空题 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母) ?
A.所需的活化能很高?B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g) 2NO(g)的平衡常数K如下表
2NO(g)的平衡常数K如下表

①该反应的△H____0。(填“>”、“=”或“<”)
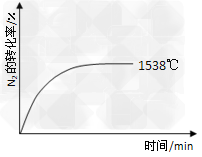
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是_________。
A.降低温度?B.加催化剂?C.增加压强?D.增加O2浓度?E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol?N2和2.6mol?O2,计算反应N2(g)+O2(g) 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(5)NO在科学界被誉为“明星分子”,?用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。且:
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol ?
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_____________________
5、选择题 已知反应A2(g)+2B2(g)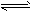 2AB2(g) △H <0,下列说法正确的是
2AB2(g) △H <0,下列说法正确的是
[? ]
A.升高温度有利于反应速率增加,从而缩短达到平衡的时间
B.升高温度,正向反应速率增加,逆向反应速率减小
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动