1、填空题 甲醇(CH3OH)作为新型汽车动力燃料,以下是甲醇在工业上的制备和生活中的应用。
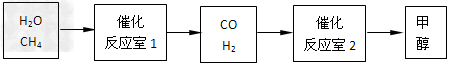
请填空: ?
(1)在压强为0.1MPa条件下,反应室2(容积为VL)中a?mol?CO与2a?mol?H2在催化剂作用下反应生成甲醇:CO?(g)?+2H2(g)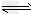 CH3OH?(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH?(g),CO的平衡转化率与温度、压强的关系如图所示,则:
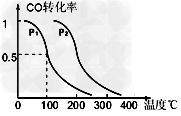
①一定条件下的密闭容器中,该反应到达平衡,要提高CO的转化率可以采取的措施是_______?(填字母代号)
A.高温高压?B.加入催化剂?C.增加CO的浓度?D.增大氢气的浓度?E分离出甲醇
②在压强P1、100℃时,CH3OH(g) CO(g)?+?2H2(g)反应的平衡常数为________(用含a、V的代数式表示)
CO(g)?+?2H2(g)反应的平衡常数为________(用含a、V的代数式表示)
③将一定量的NO2与SO2置于绝热恒容密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。
SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
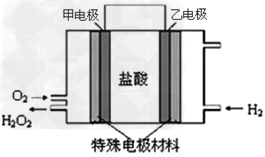
(2)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2和O2为原料制取过氧化氢的新工艺。原理如图所示:请写出甲电极的电极反应式:________________________。
(3)若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52?kJ的能量,则等质量的甲醇燃料电池利理论上可提供________mol电子的电量。(已知甲醇的燃烧热为725.76?kJ/mol)
(4)已知在常温常压下:
①2CH3OH?(l)+3O2(g)?==?2CO2(g)+4H2O?(g) ΔH1=-1275.6?kJ/mol
②2CO?(g)+O2(g)?==?2CO2(g)?ΔH2=-566.0?kJ/mol
③H2O?(g)?=?H2O?(l) ΔH3=-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________。
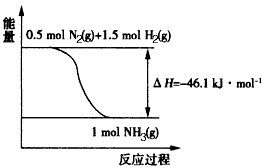
2、填空题 氨在工农业生产中应用广泛。在压强为30 MPa 时,合成氨平衡混合气体中NH3的体积分数如下

请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因____________________。
(2)根据下图,合成氨反应的热化学方程式是____________________。
(3)在一定温度下,将2 mol N2和6 mol H2通入到体积为1L的密闭容器中,发生反应N2+3H2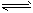 2NH3。
2NH3。
2 min达到平衡状态时,H2的转化率是50%,则用H2表示该反应的平均反应速率v(H2)=____ ;该温度下的平衡常数K=________(用分数表示);欲使K增大,可以采取的措施是___________________。
(4)从化学平衡移动的角度分析,欲提高H2的转化率可以采取的措施是____(选填字母)。
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂
3、选择题 在容积不变的密闭容器中,一定条件下发生反应:2A 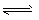 B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
[? ?]
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入稀有气体,则平衡向右移动
4、选择题 在密闭容器中,一定量混合气体发生下列反应:?aM(g)+?bN(g) ?cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是?
?cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是?
[? ]
A.反应速率增大?
B.平衡向右移动?
C.N的转化率提高? ?
D.W的体积分数降低
5、选择题 某可逆反应L (s)+G(g)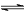 3R(g);ΔH>0。下图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
3R(g);ΔH>0。下图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
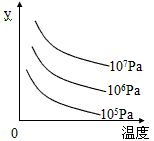
[? ]
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率