1、实验题 (16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
①?灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,?
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是?。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:?
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
实验操作
| 预期现象与结论
|
步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。
| 若不出现浑浊,则溶液中不存在SO32-,
若出现浑浊,则溶液中可能含有SO32-。
|
步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入?。
| ?
|
步骤3:
| ?
|
?
参考答案:(16分)
(1)偏低?(2分)?(2)过滤、洗涤沉淀(2分)
(3)硫酸钡会被碳还原(或“部分硫酸钡会发生分解”)(2分)
(4)NH3·H2O + SO2 = NH4+ + HSO3-?(2分)
(5)
实验操作
预期现象与结论
步骤2: 2mol/L盐酸。(1分)
若加盐酸后出现气体,则证明溶液中存在SO32-。
若无气体,则不存在SO32-。(2分)
步骤3:在试管2中加入过量2mol/L盐酸,再滴入2滴品红。
或:在试管2中加入过量lmol/L氢氧化钡溶液。(3分)
红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-。
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-。(2分)
本题解析:略
本题难度:一般
2、填空题 A、B、C、D四种可溶性盐,它们的阳离子可能分别是Ca2+、Ag+、K+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种.
(1)若把4种盐分别溶解于盛有蒸馏水的4支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的4支试管中分别加盐酸,B溶液中有沉淀产生,D溶液中有无色无味气体逸出.根据(1)(2)的实验事实推断4种盐的化学式为:
A______,B______,C______,D______.
参考答案:因Ca2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是CaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;K+对应CO32-为K2CO3,即四种物质为CaCl2、AgNO3、CuSO4、K2CO3.
(1)中由于C盐是蓝色的,所以C为CuSO4,
(2)四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;而D生成无色气体,则为二氧化碳,即D为K2CO3,所以A为CaCl2,
故答案为:CaCl2;AgNO3;CuSO4;K2CO3.
本题解析:
本题难度:一般
3、实验题 已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,在实验室中通过下述过程可从该废水中回收硫酸铜晶体及其它物质。?
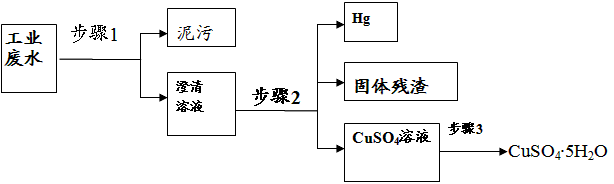
(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有___________。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)___________,生成固体残渣的的离子方程式__________。
(3)步骤3中涉及的操作是:蒸发浓缩、________、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是____________。
参考答案:(1) 过滤 , 漏斗、玻璃棒 。
(2) Cu? ;Cu +2Ag+ = Cu2+ +2 Ag 。
(3) 冷却结晶
(4) 因为Hg有挥发性,且有毒 。
本题解析:
本题难度:一般
4、填空题 (16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
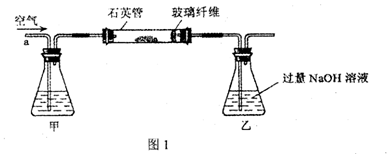
II.反应结束后,将乙瓶中的溶液进行如图2处理。

[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是?。
(2)I中,甲瓶内所盛试剂是?溶液;乙瓶内发生反应的离子方程式有?;I中玻璃纤维的作用是?。
(3)II中,所加H2O2溶液需足量的理由是?。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有?;
(5)该黄铁矿中硫元素的质量分数?(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数?(用I、II中有关实验数据表达)
参考答案:(1)FeS2(s) + 11/4 O2 (g)= 1/2Fe2O3(s) + 2SO2(g) △H=-853KJ/mol
(2) NaOH ,? SO2 + 2OH- = SO32- + H2O?防止粉尘进入导管和乙装置
(3)使SO32-全部氧化SO42-
(4)250ml容量瓶?胶头滴管量筒
(5)32m2/233m1×100%? 2.8CV/m11×100%
本题解析:I.黄铁矿灼烧的化学方程式为:FeS2+ 11/4 O2 = 1/2Fe2O3+ 2SO2,由题目所给数据可计算出1molFeS2完全反应所放出的热量为853kJ,则热化学方程式为:FeS2(s) + 11/4 O2 (g)= 1/2Fe2O3(s) + 2SO2(g) △H=-853KJ/mol
(2)I中,甲瓶内所盛试剂是为了吸收SO2,一般用碱液NaOH溶液:SO2 + 2OH- = SO32- + H2O;I中玻璃纤维主要是为了防止粉尘进入导管和乙装置,以防造成实验误差
(3)乙中为亚硫酸盐,加入过量双氧水是为了将SO32-全部氧化SO42-
(4)将滤液稀释至250mL主要应用容量瓶进行操作,期间需要用到胶头滴管、量筒等仪器
(5)由S~BaSO4可知,硫元素的质量分数为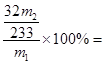 32m2/233m1×100%
32m2/233m1×100%
由5Fe~5Fe2+~KMnO4可知,铁元素的质量分数为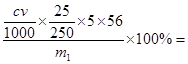 2.8cV/m1×100%
2.8cV/m1×100%
本题难度:一般
5、选择题 有六种无色试剂:C2H5OH、NaOH(aq)、C6H5OH(aq)、AgNO3(aq)、C6H6、C6H5NO2,可将它们一一鉴别出来的是( )
A.氯化铁溶液
B.高锰酸钾溶液
C.新制氢氧化铜浊液
D.溴水
参考答案:C2H5OH中滴加氯化铁溶液,不反应,也不分层;
NaOH(aq)滴加氯化铁溶液,产生红褐色沉淀;
C6H5OH(aq)滴加氯化铁溶液,溶液为紫色;
AgNO3(aq)滴加氯化铁溶液,得到白色沉淀;
C6H6滴加氯化铁溶液,不反应,分层后油状液体在上层;
C6H5NO2中滴加氯化铁溶液,不反应,分层后油状液体在下层;
则氯化铁可鉴别以上6种物质,其它选项不能鉴别,
故选A.
本题解析:
本题难度:一般