1、选择题 下列实验设计和结论相符的是?(?)
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
C.某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO
D.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
2、填空题 有以下实验装置可供选择:

Ⅰ、实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质.请回答下列问题:
(1)应选择的装置是______(填写编号);
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式______;______
(3)实验结束后,观察到溴水褪色.为解释这一现象,某学习小组的同学提出两种猜想:
A.发生了加成反应;
B.发生了氧化反应.为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH.测得溶液的pH下降,试写出褪色的化学方程式______
Ⅱ、若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式______;
(5)NaOH溶液的作用是______;
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因______;
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷______.
3、实验题 兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。

①实验I、Ⅱ的目的是____________。
②实验Ⅲ中反应的本质是(用离子方程式表示)____________________。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
①Cu作_______极。②总反应的离子方程式是________________。
4、实验题 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A.B.C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL
6mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤.小心烘干.称量。将B.C重复上面的实验。
(1)锌镀层完全反应的标志是________________________________
(2)如何检验铁片已经洗净?________________________________
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为Scm2.质量为mg的镀锌铁皮放入
6mol·L-1 NaOH溶液中。回答下列问题:
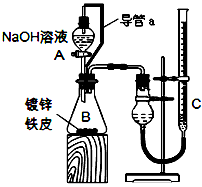
(3)装置中导管a的作用是________________________________
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温;
③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是__________________(填序号)。
5、填空题 (每空1分,共12分)
(1)浓硫酸与木炭粉在加热条件下的化学方程式为____________。
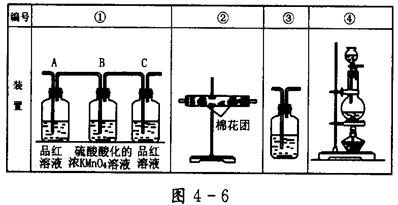
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→__________→__________→__________。
(3)实验时可观察到来源:91考试网 91eXAm.org装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是_________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______。
(5)装置③中所盛溶液是__________,可验证的产物是__________。