1、实验题 (12分)实验室用如图所示的装置制取乙酸乙酯.
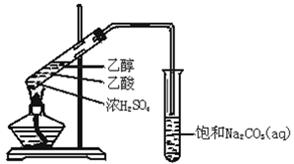
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:?,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式?。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
参考答案:(12分)

本题解析:略
本题难度:简单
2、实验题 ( 12分 ) 如图所示的装置用于制备1,2 -二溴乙烷 ( 广口瓶中的NaOH溶液是为了吸收副反应产生的SO2等 ) ,请回答下列问题:
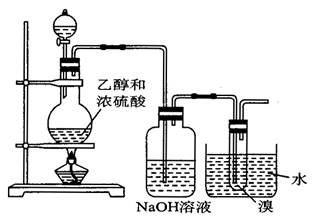
( 1 ) 加热混合物至170 ℃ 左右是为了 ____________________ 。
( 2 ) 广口瓶中NaOH溶液过量,写出吸收SO2反应的化学方程式 ___________________ 。
( 3 ) 使用水作冷却剂是为了什么?
( 4 ) 烧瓶中的混合液加热时先变棕色后变黑色是由于 _________________________ 。
( 5 ) 烧瓶中放些白瓷片,其作用是什么?
( 6 ) 生成的1,2 -二溴乙烷通常混有过量的溴,为洗去溴最好用 ______________ 。
参考答案:( 1 ) 制乙烯
? ( 2 ) SO2 + 2NaOH══Na2SO3 + H2O
? ( 3 ) 防止溴挥发
? ( 4 ) 浓H2SO4使部分乙醇氧化为碳
? ( 5 ) 防止暴沸
? ( 6 ) NaOH溶液
本题解析:该题是对实验室制乙烯的考查,原理:CH3CH2OH 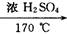 ?CH2═CH2↑ + H2O,存在的副反应有①浓H2SO4使乙醇脱水碳化,并发生2H2SO4 ( 浓 ) + C══2SO2↑ + CO2↑ + 2H2O反应,②CH3CH2OH + HO—CH2CH3
?CH2═CH2↑ + H2O,存在的副反应有①浓H2SO4使乙醇脱水碳化,并发生2H2SO4 ( 浓 ) + C══2SO2↑ + CO2↑ + 2H2O反应,②CH3CH2OH + HO—CH2CH3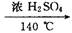 CH3CH2—O—CH2CH3 ( 乙醚 ) + H2O,所以必须控制温度在170 ℃,该题还考查了乙烯性质的验证:CH2═CH2
CH3CH2—O—CH2CH3 ( 乙醚 ) + H2O,所以必须控制温度在170 ℃,该题还考查了乙烯性质的验证:CH2═CH2 
本题难度:简单
3、实验题 两个学习小组用下图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
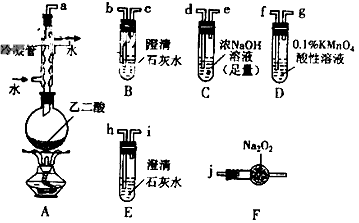
(1)甲组:
①按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有______________________;装置C的作用是______________________;E中溶液变浑浊,D中的现象是___________,证明分解产物有___________。
②乙二酸受热分解的化学方程式为___________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为______________________。
②从A-F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。最简单的装置接口连接顺序是
___________ ;实验后用F中的固体进行验证的方法是___________(可另选试剂)。
参考答案:(1)①CO2;充分除去CO2;溶液褪色或变浅;CO;
②HOOC-COOH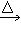 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)①2Na2O2+2CO2=2Na2CO3+O2;②a→d→e→j;取F中的固体,滴加稀硫酸,将生成的气体通入澄清石灰水,若变浑浊,则发生了反应,若不浑浊,则未发生反应。
本题解析:
本题难度:一般
4、选择题 下列实验操作与预期实验目的或实验结论不一致的是
选项
| 实验操作及现象
| 实验目的或结论
|
A
| 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
| 可证明氧化性H2O2比Fe3+强
|
B
| 在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深
| 验证盐类水解反应是吸热反应
|
C
| 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净
| 除去铁屑表面的油污
|
D
| 苯酚钠溶液中通入足量二氧化碳产生浑浊
| 苯酚的酸性弱于碳酸
|
?
参考答案:A
本题解析:
答案:A
A、不正确,用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,相当于有两种氧化剂,H2O2和HNO3均能将Fe2+氧化,无法判断是谁将Fe2+氧化;B、HCO3―+H2O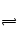 H2CO3+OH―碱性增强,平衡正向移动,正向吸热。C、正确,CO32―+H2O
H2CO3+OH―碱性增强,平衡正向移动,正向吸热。C、正确,CO32―+H2O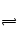 HCO3―+OH―,水解呈碱性,加热促进水解D正确,变浑有苯酚析出。
HCO3―+OH―,水解呈碱性,加热促进水解D正确,变浑有苯酚析出。
本题难度:简单
5、选择题 下列各组中的实验步骤及现象,能达到相应实验目的的是
?
| 实验目的
| 实验步骤及现象
|
A
| 检验亚硫酸钠试样是否变质
| 试样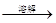 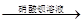 白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解
|
B
| 制取氯气并探究氯气是否具有漂白性
| MnO2和稀盐酸 气体 气体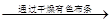 褪色 褪色
|
C
| 证明酸性条件H2O2氧化性比I2强
| 碘化钠溶液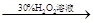  溶液变蓝色 溶液变蓝色
|
D
| 探究浓度对于化学平衡的影响
| FeCl3和KSCN混合溶液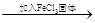 红色变深 红色变深
|
?
参考答案:D
本题解析:A、由于在酸性条件下,NO3-具有强氧化性,能把SO32-氧化生成SO42-,进而生成硫酸钡白色沉淀,所以检验亚硫酸钠是否变质时应该用氯化钡,不能用硝酸钡,A不正确;B、二氧化锰只能氧化浓盐酸制备氯气,与稀盐酸是不反应的,B不正确;C、由于稀硝酸具有强氧化性,能把碘化钾氧化生成单质碘,从而时淀粉溶液显蓝色,因此不能用稀硝酸,应该用盐酸或稀硫酸,C不正确;D、加入氯化铁固体,增大铁离子的浓度,红色加深,说明平衡向正反应方向移动,因此可以说明浓度对平衡状态的影响,D正确,答案选D。
本题难度:一般