|
高考化学知识点总结《物质的量》在线测试(2019年最新版)(十)
2019-06-28 21:23:52
【 大 中 小】
|
1、实验题 (12分)(实验题)下图为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。
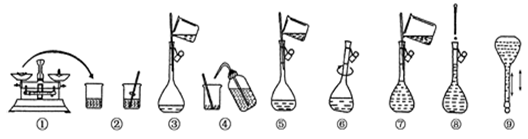
回答下列问题:
(1)①中称得Na2CO3________g;选取容量瓶规格:______________
(2)容量瓶使用前检验漏水的方法是 ____________________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________;
B.没有进行操作步骤④和⑤________;
C.在第⑤步不慎有少量液体流到容量瓶外 ________。
D.未经冷却趁热将溶液注入容量瓶中定容 ________。
| E.摇匀后发现液面低于刻度线再加水 _______
参考答案:(1) 5.3 250ml (每空2分)
(2)往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,才能使用(3分)
(3)①A偏高;B偏低; C偏低; D偏高; E偏低。(每空1分)
本题解析:实验配制250 mL 0.2 mol/L Na2CO3溶液,需选用250ml的容量瓶,所配溶液需称取Na2CO3的质量为:0.2mol/L×0.25L×106g/mol=5.3g;选取容量瓶后需检漏,方法为:往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,则容量瓶可以使用;根据 可知:定容时(步骤⑧)俯视会导致所配溶液体积V偏小,则会导致最终配置溶液的浓度偏高;没有进行洗涤转移(步骤④、⑤),则会导致n(B)减小故则会导致所配溶液浓度偏低;转移液体(步骤⑤)时液体溅出会导致n(B)减小故则会导致所配溶液浓度偏低;未经冷却趁热将溶液注入容量瓶中定容,溶液体积受热膨胀,会导致溶液体积V偏小,故所配溶液浓度偏高;摇匀后发现液面低于刻度线是因为再振荡摇匀的过程中,有一部分液体粘在了刻度线上方的器壁上,故无需补充水,所以加水后会导致所配溶液浓度偏低。 可知:定容时(步骤⑧)俯视会导致所配溶液体积V偏小,则会导致最终配置溶液的浓度偏高;没有进行洗涤转移(步骤④、⑤),则会导致n(B)减小故则会导致所配溶液浓度偏低;转移液体(步骤⑤)时液体溅出会导致n(B)减小故则会导致所配溶液浓度偏低;未经冷却趁热将溶液注入容量瓶中定容,溶液体积受热膨胀,会导致溶液体积V偏小,故所配溶液浓度偏高;摇匀后发现液面低于刻度线是因为再振荡摇匀的过程中,有一部分液体粘在了刻度线上方的器壁上,故无需补充水,所以加水后会导致所配溶液浓度偏低。
考点:一定物质的量浓度溶液的配制实验。
本题难度:一般
2、填空题 某同学按下列步骤配制100mL?1.00mol/LNaCl溶液.
①计算所需NaCl固体的质量
②称量NaCl固体
③将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解
④将烧杯中的溶液注入容量瓶(已检查是否漏液),并用少量蒸馏水洗涤烧杯2~3次,洗涤液也注入容量瓶
⑤向容量瓶中加蒸馏水至距刻度线1~2cm处
⑥将容量瓶盖紧,振荡,摇匀
请回答有关问题:
(1)用托盘天平称量固体NaCl的质量为______g.
(2)为了加速溶解,可以采取的措施是______.
(3)使用容量瓶的规格是______?mL.
(4)该同学实验中明显缺少的一步操作是______.
(5)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求______(填“大”或“小”)了.
参考答案:(1)m=CVM=1.00mol/L×0.1L×58.5g/mol=5.9g,故答案为:5.9g;?
(2)为了加速固体的溶解可以采用搅拌的方法,故答案为:搅拌;?
(3)实验室有100mL的容量瓶,所以应该使用100mL的容量瓶,故答案为:100mL;
(4)向容量瓶中加蒸馏水至距刻度线1~2cm处时要进行定容,定容的操作方法是:用胶头滴管滴加水至凹液面最低处与刻度线平齐,故答案为:改用胶头滴管滴加水至凹液面最低处与刻度线平齐;?
(5)根据C=nV知,将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,则配制溶液的浓度偏小,故答案为:小.
本题解析:
本题难度:一般
3、计算题 为测定某碳酸钠样品的纯度,取一定量碳酸钠(Na2CO3)样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不参与反应),生成二氧化碳气体224mL(标准状况)。
(1)写出该反应的化学方程式________________________________________;
(2)碳酸钠的摩尔质量为___________________;
(3)该碳酸钠样品中碳酸钠的质量为______________;
(4)参与反应的盐酸的物质的量浓度______________;
参考答案:(1) Na2CO3 + 2HCl=2NaCl + CO2↑+ H2O
(2) 106 g·mol-1?(3) 1.06g ; ? (4) 0.5mol/L
本题解析:(1)碳酸钠和盐酸反应生成氯化钠、水和CO2,所以反应的化学方程式是Na2CO3 + 2HCl=2NaCl + CO2↑+ H2O。
(2)碳酸钠的相对分子质量是23×2+12+16×3=106,所以摩尔质量是106g/mol。
(3)生成的CO2的物质的量是0.224L÷22.4L/mol=0.01mol,所以根据反应的化学方程式可知,参加反应的碳酸钠的物质的量也是0.01mol。则根据m=n·M可知,碳酸钠的质量是0.01mol×106g/mol=1.06g。
(4)同样根据反应的化学方程式可知,参加反应的盐酸的物质的量是0.01mol×2=0.02mol,则盐酸的物质的量浓度是0.02mol÷0.04L=0.5mol/L。
点评:该题是基础性试题的考查,该题做题的关键是熟练应用几个关系式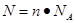 、n=m/M、 、n=m/M、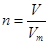 、 、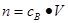 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。该题有利于培养学生的规范答题能力,难度不大,学生不难得分 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。该题有利于培养学生的规范答题能力,难度不大,学生不难得分
本题难度:一般
4、选择题 有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是(?)
A.FeO
B.Fe2O3
C.Fe3O4
D.FeO和Fe2O3
参考答案:B
本题解析:CO和铁的氧化物反应时,氧化物中的一个O原子对应一个CO2分子,每一个CO2分子对应一个CaCO3,所以有下列的关系式,假设0.4 g该氧化物中含x g O原子。
O ~ CO2 ~ CaCO3
16?100
x g?0.75 g
解得x=0.12
N(Fe)∶N(O)=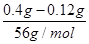 ∶ ∶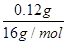 =2∶3。 =2∶3。
故此氧化物的化学式为Fe2O3。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数,下列叙述正确的是
A.标准状况下,11.2LH2O所含分子数为0.5NA
B.1 mol·L-1CaCl2溶液中所含Ca2+离子的数目为NA
C.通常状况下,32gO2与32gO3所含的氧原子数均为2NA
D.7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA
参考答案:C
本题解析:
A:错在:没有明确气体摩尔体积使用的条件,和标准状况含义为:0℃?一个标准大气压。此时水为固液混合体。
B:错在:没有明确物质的量浓度的含义。钙离子个应该要知道溶液的体积。
C:正确。正确理解摩尔质量的计算公式和抓住两种物质组成的共同点:n(O)= ="2" mol ="2" mol
D:错在:没有明确化学反应中作氧化剂和还原剂的氯气比为:1︰1
Cl2 + 2NaOH =" NaCl" + NaClO + H2O
n(Cl2)=  =" 0.1" mol 作氧化剂的为:0.1÷2=" 0.05" mol =" 0.1" mol 作氧化剂的为:0.1÷2=" 0.05" mol
转移电子为:0.05×2 =" 0.1" mol 则个数为:0.1NA
本题难度:一般
|