1、计算题 (8分)已知某饱和氯化钠溶液体积为VmL,溶液密度为d g·cm-3,溶质的质量分数为ω%,物质的量浓度为c mol·L-1,溶液中含NaCl的质量为m g。
(1)用ω表示该温度下NaCl的溶解度是 。
(2)用m、V表示溶液的物质的量浓度是 。
(3)用ω、d表示溶液的物质的量浓度是 。
(4)用c、d表示溶液中溶质的质量分数是 。
参考答案:(每空2分)(1)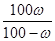 g (2)
g (2)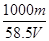 mol/L 或 17.1m/Vmol·L-1
mol/L 或 17.1m/Vmol·L-1
(3) 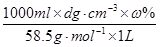 或0.171dωmol·L-1 (4)
或0.171dωmol·L-1 (4) 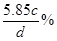
本题解析:考查物质的量的有关计算。
(1)溶解度是在一定条件下,在100g水中溶解达到饱和时所能溶解的质量。由于饱和溶液中溶质的质量分数是ω%,所以溶解度S=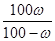 g。
g。
(2)溶液的体积是Vml,含有溶质氯化钠的质量是mg,物质的量是m/58.5mol,所以根据c=n/V可知,溶液的浓度是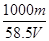 mol/L 或 17.1m/Vmol·L-1。
mol/L 或 17.1m/Vmol·L-1。
(3)根据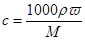 可知,溶液的浓度是
可知,溶液的浓度是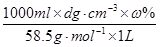 或0.171dωmol·L-1。
或0.171dωmol·L-1。
(4)溶液的质量是Vdg,而溶质的质量是0.001Vcmol,质量是0.001Vcmol×58.5g/mol=0.0585Vcg,所以溶质的质量分数是0.0585Vcg÷Vdg×100%=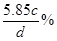
本题难度:一般
2、选择题 下列关于摩尔的叙述正确的是
A.表示物质数量的单位
B.表示物质质量的单位
C.表示物质微粒的单位
D.表示物质的量的单位
参考答案:D
本题解析:摩尔是表示物质物质的量的单位
本题难度:简单
3、填空题 (10分)A、B、C、 D四种溶液分别是NaOH溶液、氨水、 CH3COOH溶液、盐酸中的一种。常温下:
①浓度均为0.1mol·L-1的A和C溶液,pH:A<C<7;
②将1 L pH=3的A溶液分别与0.001mol·L-1?xL B溶液、0.001mol·L-1?yL D溶液充分反应至中性,x、y大小关系为: y<x;
回答下列问题:
(1)D是?(填化学式)溶液;?
(2)②中1LpH=3的A溶液与0.001mol·L-1 xL B溶液充分反应至中性,所 得溶液中各种离子的物质的量浓度由大到小的顺序为?。
得溶液中各种离子的物质的量浓度由大到小的顺序为?。
(3)常温下,等体积且等物质的量浓度的C溶液和D溶液充分混合后所得溶液的pH
?7(填“>”、“<”或“=”),用离子方程式解释其原因?。
(4)向pH相同且等体积的两份溶液A和C中,分别投入质量不同的锌粉反应,若放出氢气的质量相同,则下列说法正确的是?(填写序号)。
①开始反应时的速率A>C?②反应所需要的时间C>A?
③参加反应的锌粉物质的量A="C?" ④A溶液里有锌粉剩余
参考答案:(1)NaOH (2分)?
(2)c(NH4+)= c(Cl-)> c(H+)= c(OH-)?(2分)
(3)>(1分)?CH3COO-+ H2O? ?CH3COOH+ OH-?(3分)
?CH3COOH+ OH-?(3分)
(4)③④(2分)
本题解析:略
本题难度:简单
4、选择题 150 ℃时,碳酸铵完全分解,生成的气态混合物密度是相同条件下H2密度的( )
A.96倍
B.48倍
C.24倍
D.12倍