1、填空题 否定一句话只要一个反例就够了,请各找一个学过的化学反应方程式,否定以下各错误观点,例如:“氧化反应一定是化合反应。”证明它错误的实例:CH4+2O2 CO2+2H2O
CO2+2H2O

参考答案:(1)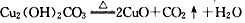
(2)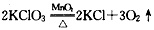
(3)
(4)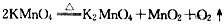
本题解析:
本题难度:一般
2、填空题 (8分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式?
(2)已知:Se+2H2SO4(浓) = 2SO2↑+SeO2+2H2O?2SO2+SeO2+2H2O = Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是?
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O?②I2+2Na2S2O3 = Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目?
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为?
参考答案:(1)Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑?(2)H2SO4(浓)>SeO2>SO2 ?
(3)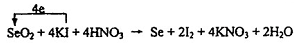 (4)92.5﹪
(4)92.5﹪
本题解析:根据题意,结合氧化还原反应中的电子守恒的知识,可得方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑;(2)在氧化还原反应中,氧化性:氧化剂>氧化产物;氧化剂>还原剂。可得氧化性由强到弱的顺序是:H2SO4(浓)>SeO2>SO2 ;(3)①的配平方程式及电子转移表示为: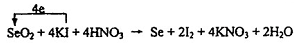 ;(4)根据氧化还原反应中电子转移数目相等,结合方程式可得关系式:SeO2~2I2~4 Na2S2O3,n(Na2S2O3)= 0.2000 mol/L×0.025L=5×10-3mol,所以n(SeO2)=1.25×10-3mol,m(SeO2)= 1.25×10-3mol×111g/mol=0.1388g。准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为0.1388g÷0.1500g92.5﹪。
;(4)根据氧化还原反应中电子转移数目相等,结合方程式可得关系式:SeO2~2I2~4 Na2S2O3,n(Na2S2O3)= 0.2000 mol/L×0.025L=5×10-3mol,所以n(SeO2)=1.25×10-3mol,m(SeO2)= 1.25×10-3mol×111g/mol=0.1388g。准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为0.1388g÷0.1500g92.5﹪。
本题难度:一般
3、填空题 氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为?。
 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)? 4NO(g)+6H2O(g)。
起始浓度( mol/L)
| C(NH3)
| C(O2)
| C(NO)
| C(H2O)
|
甲
| 1
| 2
| 0
| 0
|
乙
| 4
| 8
| 0
| 0
|
丙
| 0.2
| x
| y
| z
|
?
①恒温恒容下,平衡时NH3的转化率甲?乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=?,y=?,z= ?.
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_?a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_?a2。
A.大于? B.小于? C.等于? D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是?。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:?。反应过程中,氧化剂和还原剂物质的量之比为?。
(2)若反应中生成0.2mol HNO3,转移的电子数目为?。
参考答案:14分)Ⅰ.(10分)(1)9mL和14.25mL(2分)
(2)①>(1分)?② 1,0.8,1.2(各1分)
(3)D(2分)
(4)c(NO-3)>c(H+)>c(NH+4)>c(OH-)(2分)
Ⅱ . (4分)
(1)3NF3+5H2O=9HF+2NO+HNO3(2分)? 2:1 (1分)
(2)2.408×1023 或0.4NA(1分)(写成物质的是不给分)
本题解析:I.(1)4NO+3O2+2H2O=4HNO3,剩余气体3mL,过量气体可能是O2或NO,若是O2过量,NO全部参加反应,根据4NO~3O2,V(O2)= 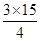 +3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)=
+3=14.25mL,若是NO过量,参加反应的NO为12ml,根据4NO~3O2,V(O2)= 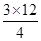 =9mL;
=9mL;
(2)①恒温恒容,乙中投料是甲中投料的4倍,等同于增大压强,平衡逆向移动,因此甲>乙;
②根据等效平衡可知,丙中转化为起始量与甲中的起始量相同,则
4NH3(g)+5O2g)?4NO(g)+6H2O(g),
起始1?2
丙 0.2? x? y? z
则0.2+y=1, x?+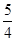 y?=2?z =
y?=2?z = 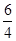 y
y
解得y?=0.8,x=1,z=1.2;
(3)恒温恒容下反应相同时间,T1<T2,两个密闭容器中分别充入等量NO2,在T1下,达到平衡时,所用时间为t1,在T2时,在t1时间时已达到平衡,因为升高温度,平衡逆向移动,所以a1>a2,选择时间小于t1,在相同时间内,在T2时,尚未达到平衡,反应正向移动,则有a1小于或等于a2,故答案为:D;
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,得到硝酸铵和硝酸的混合溶液,且二者物质的量相等,二者中都含有NO3-,它浓度最大,NH4+水解,因此C(H+)>C(NH4+),C(OH-)最小,c(NO-3)>c(H+)>c(NH+4)>c(OH-);
Ⅱ.3NF3+5H2O=9HF+2NO+HNO3,NF3既是氧化剂又是还原剂,其中N化合价是+3价,体现氧化性有2mol降到+2价,体现还原性有1mol升到+5价,氧化剂和还原剂物质的量之比为2:1,反应中每有1mol硝酸生成,转移电子2mol,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA。
本题难度:困难
4、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO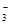 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH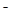 、Al(OH)3、NO
、Al(OH)3、NO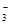 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为?。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为?;正极材料采用了铂网,利用铂网为正极的优点是?。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g)?△H=-2834.9kJ/mol
Fe2O3(s)+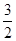 C(s)=
C(s)= 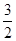 CO2(g)+2Fe(s)?△H=234.1kJ/mol
CO2(g)+2Fe(s)?△H=234.1kJ/mol
C(s)+O2(g)=CO2(g)?△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式?。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:

则反应过程中产生氢气的总体积为?L(标准状况)。
参考答案:
(1)NO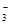 +Al+H2O→Al(OH)3+N2+OH-? 5:3
+Al+H2O→Al(OH)3+N2+OH-? 5:3
(2)2H2O+O2+4e-=4OH-
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积。
(3)2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)?△H=-593.1kJ/mol
(4)2.016
本题解析:
分析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al元素的化合价升高,在反应中被氧化,N元素的化合价降低,在反应中被还原,利用电子守恒来计算;
(2)根据电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,再利用铂的性质及网状结构分析其优点;
(3)根据已知的反应和盖斯定律来计算目标反应的反应热,并书写热化学反应方程式;
(4)根据2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑、NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,结合图象来计算金属的物质的量,再利用电子守恒来计算氢气的物质的量,最后计算其体积.
解答:解:(1)由金属铝将水体中的NO3-转化为N2可知,在NO3-+Al+H2O→Al(OH)3+N2+OH-中,Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,
x×(3-0)=y×(5-0),
解得x:y=5:3,
即被氧化与被还原的元素的物质的量之比为5:3,故答案为:5:3;
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,
正极反应为2H2O+O2+4e-=4OH-,
又正极材料使用铂网,是因铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积,
故答案为:2H2O+O2+4e-=4OH-;铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积;
(3)由①4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol,
②Fe2O3(s)+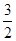 C(s)=
C(s)=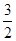 CO2(g)+2Fe(s)△H=234.1kJ/mol,
CO2(g)+2Fe(s)△H=234.1kJ/mol,
③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,
根据盖斯定律可知,①×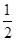 +②-③×
+②-③×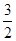 可得,
可得,
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol,
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol;
(4)由2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑、NaOH+HCl═NaCl+H2O、
NaAlO2+HCl+H2O═Al(OH)3↓+NaCl可知,
反应后n(Na)=n(NaCl)=n(NaOH)+n(NaAlO2),
由图象可知,30mL盐酸生成沉淀最大,则n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,
由合金全部溶解后得到20mol,pH=14的溶液,n(NaOH)=0.02L×1mol/L=0.02mol,
则n(Al)=n(NaAlO2)=0.06mol-0.02mol=0.04mol,
即合金中Na为0.06mol、Al为0.04mol,设反应过程中产生氢气的物质的量为n,
由电子守恒可知,0.06mol×1+0.04mol×3=n×2×1,
解得n=0.09mol,
所以在标况下其体积为0.09mol×22.4L/mol=2.016L,
故答案为:2.016.
点评:本题考查氧化还原反应、原电池、盖斯定律计算反应热、化学反应与图象的计算,难度较大,知识的综合性较高,(4)是学生解答中的难点,注意守恒法在解题中的重要作用.
本题难度:一般
5、选择题 下列有关氧化还原反应的叙述正确的是
[? ]
A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂
B.金属原子越容易失去电子,其氧化性越强
C.某元素由化合态转化为游离态,该元素一定被氧化
D.物质所含元素化合价降低的反应是还原反应
参考答案:D
本题解析:
试题分析:
选项A,金属单质在氧化还原反应中只能作还原剂,非金属单质可以作氧化剂,也可以作还原剂。
选项B,金属原子越容易失去电子,其还原性越强。
选项C,某元素由化合态转化为游离态,该元素可能被氧化,也可能被还原。
选项D,物质所含元素化合价降低的反应是还原反应。
故选:D
本题难度:简单