1、选择题 LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( )。
A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
B.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1
C.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子
D.LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O=Al(OH)3+LiOH+4H2↑
参考答案:B
本题解析:LiAlH4中氢显-1价,具有很强的还原性;A项,乙醛→乙醇,发生还原反应,正确;B项,生成氢气的实质是LiAlH4中-1价的H与D2O中+1价D归中生成HD气体,摩尔质量为3 g·mol-1,错误;C项,Al3+生成Al,转移3e-,正确;D项,该反应相当于水解,Al(OH)3溶于酸和强碱不溶于水,LiOH是中强碱,不溶,正确。
本题难度:一般
2、选择题 下列反应中属于氧化还原反应,且水作为氧化剂的是
A.Cl2 + H2O =" HCl" + HClO
B.2F2 + 2H2O =" 4HF" + O2
C.2Na + 2H2O =" 2NaOH" + H2↑
D.2Na2O2 + 2H2O =" 4NaOH" + O2↑
参考答案:C
本题解析:
正确答案:C
四个反应都是氧化还原反应, A、水既不作氧化剂,也不作还原剂;B、不只作还原剂;C、水作氧化剂,部分被还原D、水既不作氧化剂,也不作还原剂。
本题难度:简单
3、选择题 下列说法正确的是(?)
A.当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+
C.用浓盐酸酸化KMnO4溶液以增强其氧化性
D.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1
参考答案:B
本题解析:Na2O2与H2O反应中,Na2O2即是氧化剂,又是还原剂,2molNa2O2发生反应转移电子2mol,A错误;Fe2+与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2蓝色沉淀,B正确;KMnO4氧化性强于Cl2,高锰酸钾溶液能与盐酸反应(2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O),高锰酸钾溶液不能用盐酸酸化,一般用硫酸酸化,C错误;3NO2+H2O=2HNO3+NO反应中,氧化剂和还原剂都是NO2,氧化剂和还原剂物质的量比为1:2,D错误。
点评:检验Fe2+的反应源自课本【实验探究】栏目,对这类栏目不可忽视。
本题难度:一般
4、选择题 接触法制硫酸和氨氧化法制硝酸分别经过以下主要变化: ? 下列说法中正确的是
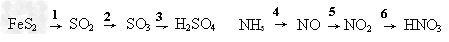
[? ]
A.所有变化都是氧化还原反应
B.2、3、4、5等四个反应都是化合反应
C.反应2、4、6需要催化剂?
D.3是化合反应?,?6是氧化还原反应
参考答案:D
本题解析:
本题难度:简单
5、填空题 (6分)已知反应:2H2CrO4 + 3H2O2?2Cr(OH)3 + 3O2↑+ 2H2O该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是??
(2)用单线桥法表示反应中电子转移的方向和数目
2H2CrO4 + 3H2O2?2Cr(OH)3 + 3O2↑+ 2H2O
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为?
参考答案:(6分)
(1)H2O?
(2)2H2CrO4 + 3H2O2?2Cr(OH)3 + 3O2↑+ 2H2O
(3)? 6.72L?
本题解析:略
本题难度:一般