1、选择题 常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是(?)
A.a不可能显酸性
B.b不可能显中性
C.a可能显酸性或碱性
D.b可能显碱性或者酸性
参考答案:C
本题解析:由于不知道酸的酸性强弱程度,所以与氨水混合后酸碱性不定。与氢氧化钠溶液混合后,可能为中性(强酸)或酸性(弱酸)。故答案为C
本题难度:一般
2、选择题 常温下,下列说法不正确的是
A.0.1 mol/L的Na2SO3溶液中粒子浓度关系:c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
B.将常温下pH=12的氢氧化钠溶液与pH=2的醋酸溶液等体积混合后,溶液呈碱性
C.把等体积的1×10-5 mol/L的硫酸与4×10-5 mol/L的NaOH溶液相混合,混合液的pH值与5×10-6 mol/L的Ba(OH)2溶液的pH值相同
D.0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-) = c(CH3COO-)-c(CH3COOH)
参考答案:B
本题解析:B项:PH为2的盐酸与PH为12的氢氧化钠等体积混合,PH刚刚好为7,为中性,故错。故选B。
点评:本题考查:①混合溶液中离子浓度的关系,②等pH的溶液中物质的量浓度的大小关系③电离和水解的相互关系④酸式盐溶液中离子的浓度大小关系,做题时注意电荷守恒、物料守恒的运用。
本题难度:简单
3、选择题 下列说法中错误的是
A.0.5 L 2 mol·L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个
B.制成0.5 L 10 mol·L-1的盐酸,需要标准状况下的氯化氢气体112 L
C.从1 L 1 mol·L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol·L-1
D.10 g 98%的硫酸(密度为1.84 g·cm-3)与10 mL18.4 mol·L-1的硫酸的浓度不同
参考答案:D
本题解析:0.5 L 2 mol·L-1 AlCl3溶液中氯化铝的物质的量是0.5 L× 2 mol/L=1mol,氯化铝溶于水,Al3+水解,所以Al3+和Cl-总数小于4×6.02×1023个,A正确;0.5 L 10 mol·L-1的盐酸中氯化氢的物质的量是0.5L×10mol/L=5mol,则在标准状况下氯化氢的体积是5mol×22.4L/mol=112L,B正确;溶液是均一、稳定的,则从1 L 1 mol·L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol·L-1,选项C正确;选项D中根据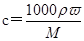 可知,98%的硫酸(密度为1.84 g·cm-3)的浓度=
可知,98%的硫酸(密度为1.84 g·cm-3)的浓度=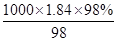 =18.4 mol/L,所以选项D不正确,答案选D。
=18.4 mol/L,所以选项D不正确,答案选D。
点评:该题是中等难度的试题,主要是考查学生对一定物质的量浓度溶液的含义、计算依据的熟悉了解程度,有利于培养学生的逻辑推理能力和规范答题能力。该题的易错点是选项A,注意铝离子的水解。
本题难度:简单
4、选择题 下列说法正确的是
A.0.01 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,所得溶液中c(H+)=c(OH-)
B.氯水中离子浓度大小关系是:c(H+)>c(Cl-)>c(OH-)>c(ClO-)
C.25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则a>b
D.25℃时,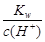 =0.1 mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1 mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
参考答案:D
本题解析:A错,0.01 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合两溶液恰好完全反应生成氯化铵,由于铵根离子的水解溶液显酸性,即所得溶液中c(H+)>c(OH-);
B错,氯水中离子浓度大小关系是:c(H+)>c(Cl-)>c(ClO-)>c(OH-);
C错,25℃时,将pH=a的醋酸溶液稀释10倍后,溶液中氢离子浓度减小,即pH增大,所以b>a
D正确,25℃时,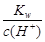 =
=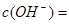 0.1 mol·L-1的溶液为碱性溶液,在碱性溶液中Na+、CO32-、Cl-之间不反应,一定能大量共存。
0.1 mol·L-1的溶液为碱性溶液,在碱性溶液中Na+、CO32-、Cl-之间不反应,一定能大量共存。
本题难度:简单
5、选择题 将0.1mol L-1的下列物质的水溶液,从常温加热到90℃,溶液的pH不变的是
A.氯化钠
B.硫酸
C.氢氧化钠
D.葡萄糖
参考答案:B
本题解析:氯化钠和葡萄糖溶液常温呈中性,pH=7,加热到90℃,Kw增大,c(H+)=c(OH-),溶液仍呈中性,但Kw增大,c(H+)和c(OH-)均增大,pH减小;0.1mol/L硫酸中c(H+)=0.2mol/L,加热到90℃,c(H+)不变,pH不变;0.1mol/LNaOH溶液中c(OH-)=0.1mol/L,升温到90℃,c(OH-)不变,但Kw增大,所以c(H+)增大,pH减小。
点评:水的电离是吸热过程,升高温度,Kw增大。
本题难度:一般