1、选择题 m g FeO、Fe2O3、CuO的混合物,加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将m g的混合物用CO气体加热还原,实验过程中耗去标准状况下的CO3.36升,得固体w g。则w的值为
A.m-0.96
B.m-1.44
C.m-1.6
D.m-2.4
参考答案:B
本题解析:向所得溶液中加入NaOH溶液,是为了中和体系中的硫酸,故体系中硫酸为0.03mol。所以生成金属硫酸盐的硫酸根离子为0.12-0.03=0.09mol。因原氧化物中氧原子数目与金属硫酸盐中硫酸根离子数目相等,故混合物中的氧原子也为0.09mol,质量为0.09*16=1.44克,所以混合物中金属的质量w=m-1.44。
故选B
本题难度:简单
2、填空题 (14分)甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成。常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物。试回答下列问题:
(1)甲的结构式?。
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为?(写化学式)。16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为?。
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式?。
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。
①写出其离子方程式?。
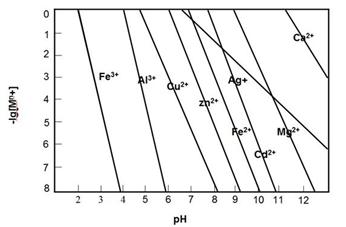
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到?沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如下图)。
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
参考答案:(1)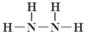 (2分)
(2分)
(2) N2H6SO4?(2分)? N2H4(l) + O2(g) ="=" N2(g) + 2H2O(g)?ΔH=-622kJ/mol? (2分)
(3) N2H4 + 4CuO ="=" 2Cu2O + N2 + 2H2O? (2分)
(4)①2Fe3+ + Cu2O + 2H+ ="=" 2Fe2+ + 2Cu2+ + H2O? (2分)
②Fe(OH)3?(2分)
③分离出有机相,加入一定浓度的硫酸,若得到蓝色溶液,则证明有机相中含有铜元素? (2分)
本题解析:(1)甲中氮的质量分数较大,则另一元素为氢,该化合物应为肼(N2H4),其相对分子质量与氧气相等。(2)肼是一种二元碱,则可以与2个H+结合,故肼与过量硫酸反应时可生成一种盐N2H6SO4。16g肼为0.5mol,则1mol肼完全燃烧放热622kJ。(3)乙为氧化亚铜,丙为氧化铜,肼与氧化铜反应生成的气体应为氮气,化学方程式为:N2H4 + 4CuO ="=" 2Cu2O + N2 + 2H2O。(4)①由于Fe3+的氧化性,可以氧化乙中+1的铜,生成Cu2+,Fe3+被还原为Fe2+,配的化学方程式为:2Fe3+ + Cu2O + 2H+ ="=" 2Fe2+ + 2Cu2+ + H2O。②由于硫酸和硫酸铁过量,则所得混合溶液中的阳离子有H+、Fe3+、Fe2+、Cu2+,且浓度均为0.1mol/L,再向溶液中加入的CuO与H+反应,溶液酸性减弱,pH逐渐增大,从图像上可看出,最先析出的沉淀为Fe(OH)3。③通过分液得到有机相,在有机相中加入一定浓度的硫酸,使铜离子再生,通过溶液显蓝色可作判断。
本题难度:一般
3、选择题 向2mL 0.5mol/L的FeCl3溶液中加入3mL 3mol/L KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(?)
A.Fe3+不与I-发生反应
B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱
D.Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
参考答案:B
本题解析:由题意可知,向FeCl3溶液中加入过量的KF溶液后,溶液褪色,说明Fe3+?已经与F-?生成了新物质,但不可能发生氧化还原反应,因为F-?的还原性极差,Fe3+?不可能氧化它;再者,向褪色后的溶液中继续加入KI溶液和CCl4振荡后静置,CCl4层不显色,说明Fe3+?与F-?结合生成的新物质不能氧化I-?,或者说不与I-?反应,故答案为B
本题难度:一般
4、推断题 (7分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
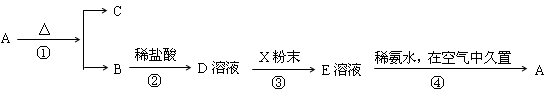
(1)请写出下列物质的化学式:A?、C?。
(2)在①②③④各步反应中属于氧化还原反应的有?(填序号)。
(3)请分别写出反应②的化学方程式和反应③的离子方程式:②?、③?。
参考答案:(1)A:Fe(OH)3? C:H2O
(2)③④
(3)Fe2O3 +6HCl===2FeCl3+3H2O? 2Fe3++Fe===3Fe2+
本题解析:由“E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色物质A”可推知A为氢氧化铁,则推知B为氧化铁,C为水,D为氯化铁,E为氯化亚铁。故
(1)A:Fe(OH)3? C:H2O
(2)①2Fe(OH)3 ?Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
?Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
②Fe2O3 +6HCl=2FeCl3 +3H2O,无化合价的变化,属于非氧化还原反应。
③2FeCl3 +Fe=3FeCl2,Fe的化合价发生改变,属于氧化还原反应。
④4Fe(OH)2 +O2 +2H2O=4Fe(OH)3,Fe的化合价发生改变,属于氧化还原反应。
故答案是③④
(3)根据(2)的答案可知:Fe2O3 +6HCl===2FeCl3+3H2O? 2Fe3++Fe===3Fe2+
点评:熟悉物质的特殊性质作为推断题的突破口。结合题目的信息逐一确定。
本题难度:一般
5、实验题 高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:

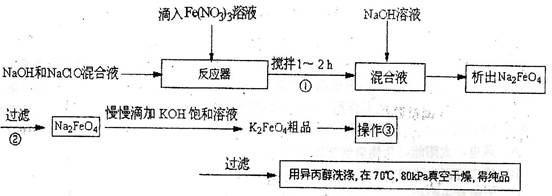
试回答下列问题
(1)操作①搅拌的目的是:_______________________。
(2)操作③名称是:______________________________。
(3)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为;_________。配制该质量浓度的溶液所需的玻璃仪器有:__________________。
(4)反应器中,NaOH、NaClO及Fe(NO3)3反应的化学方程式:
_____________________________________________________
参考答案:

本题解析:(1)根据题给信息,搅拌的目的主要是增大反应物的接触面积,进而加快反应速率。
(2)提纯晶体常用的方法主要是重结晶。
(3)此时次氯酸钠溶液的密度为270g/L,根据cM=1000ρω可以将质量浓度转换为物质的量浓度。
(4)准确判断反应物和生成物
本题难度:一般