1、选择题 在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  ?2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
?2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
2、选择题 一定条件下,可逆反应?,X(g)+3Y(g) 2Z(g)若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达?平衡时X、Y、Z的浓度分别为0.1mol/L、0.3?mol/L、0.08?mol/L,则下列判断不合理的是
2Z(g)若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达?平衡时X、Y、Z的浓度分别为0.1mol/L、0.3?mol/L、0.08?mol/L,则下列判断不合理的是
[? ]
A.c1:c2=1:3?
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14?mol/L
3、填空题 合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 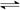 ?2NH3(g)?△H = -92 kJ·mol-1
?2NH3(g)?△H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是?(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是?。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ?(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将___?____(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ______?______。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ___?_____mol。
4、选择题 将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经2s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g),若经2s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·(L·s)-1
②用物质B表示的反应的平均速率为0.6 mol·(L·s)-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是
[? ]
A.①③
B.①④
C.②③
D.③④
5、选择题 440℃时2SO2(g) + O2(g) 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
?
| 甲
| 乙
| 丙
|
起始物质的量
| n(SO2) / mol
| 0.4
| 0.8
| 0.8
|
n(O2) / mol
| 0.24
| 0.24
| 0.48
|
SO2的平衡转化率
| 80%
| α1
| α2
|
下列判断中,错误的是
A.甲中SO2的速率为0.032mol·L-1·min-1?B.440℃时,平衡常数K=400
C.温度高于440℃时,平衡常数K>400? D.平衡时,SO2的转化率:α1<80%<α2