1、填空题 A、B、C、D、E、F、G元素原子序数依次增大。已知B原子最外层有3个未成对电子,C原子最外层电子数与核外电子总数之比为3:4,E与C同主族,F-、D+、A+离子的半径逐渐减小,化合物AF常温下为气体,G的基态原子核外M能层填满电子,N能层只有1个电子。
据此回答下列问题:
(1)写出D元素基态原子的核外电子排布式?;B、C、E三种元素的第一电离能由大到小的顺序是(用元素符号表示)?
(2)A与C可形成1 8电子分子,其水溶液中滴人少量氯化铁溶液时有大量气泡逸出,写出该反应的化学方程式 ?
(3)某化合物由上述七种元素中的三种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为?;该化合物水溶液不呈中性的原因是(用离子方程式表示)??。
(4)0.3molG的低价氧化物能与?molB的最高价氧化物对应水化物的溶液恰好完全反应(设还原产物只有BO)。
(5)卫星零射时可用B2A4为燃料,l mol气态B2A4在适量C2中燃烧,生成B2和气态A2C,放出534 kJ的热量,l mol液态A2C完全气化需吸收44 kJ热量。请写出气态B2A4在C2中燃烧生成B2和液态A2C时的热化学方程式?。
参考答案:(15分)
(1) ls22s22p63sl? (2分)? N>O>S? (2分)
(2)2H2O2 2H2O+O2↑?(2分)
2H2O+O2↑?(2分)
(3)离子键、(极性)共价键?(2分)? ClO-+H2O HClO+ OH-(2分)
HClO+ OH-(2分)
(4)1.4?(2分)
(5)N2H4 (g)+O2 (g) =N2 (g)+ 2 H2O(1)? ΔH= -622KJ/mol? (3分)
本题解析:根据题意可知A、B、C、D、E、F、G分别为H、N、O、Na、S、Cl、Cu;
(1)第一电离能同周期从左到右为增大趋势,从上到下依次减小,N为半充满状态,反常,故有N>O>S。
(2)AC形成18电子物质,可以采用9+9,确定为H2O2,在三氯化铁催化下发生分解,生成氧气和水;
(3)由消毒剂可以对该物质进行猜测为NaClO,然后进行相关的推断;
(4)3Cu2O+14HNO3=6Cu(NO3)2+2NO+4H2O,故0.3mol反应,消耗HNO31.4mol;
(5)N2H4 (g)+O2 (g) =N2 (g)+ 2 H2O(g)? ΔH= -534KJ/mol;
H2O(g)=H2O(l)? ΔH= -44KJ/mol;根据盖斯定律可以计算得到反应热,写出热化学方程式。
本题难度:一般
2、选择题 关于原子序数从11依次增加到17的元素,下列叙述错误的是(?)
A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正价数值逐渐增大
D.从硅到氯负价-4→-1
参考答案:A
本题解析:从Na→Cl,原子半径逐渐减小,最高正价从+1→+7,最低负价从Si→Cl,-4→-1。从Na→Cl,电子层数都是3,是不变的。
本题难度:简单
3、选择题 19世纪,提出近代原子论的科学家是?;英国科学家?提出了原子结构的葡萄干面包模型;?提出了原子结构的行星模型,依据是α粒子散射实验。
参考答案:道尔顿?汤姆孙?卢瑟福
本题解析:①1808年,英国科学家道尔顿提出了原子论;②1904年汤姆孙提出的葡萄干面包原子模型;③1911年卢瑟福提出原子结构行星模型。
本题难度:简单
4、选择题 下列叙述正确的是
A.1H和2H是不同的核素,它们的质子数相同
B.14C和14N的质子数不等,它们的中子数相等
C. 6Li和7Li的质子数相等,电子数也相等
D.13C和14C属于同一种元素,它们的质量数相等
参考答案:AC
本题解析:14C和14N的质子数不等,中子数也不相等,分别是8个和7个,B不正确;13C和14C属于同一种元素,它们的质量数不相等,分别是13和14,D不正确,AC正确,答案选AC。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题侧重对基础性知识的巩固与检验,有利于调动学生的学习兴趣,培养学生的学习积极性。该题的关键是记住组成原子的几种微粒之间的关系,然后灵活运用即可。
本题难度:简单
5、填空题 (5分)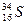 微粒中的质子数是??,中子数是??,核外电子数是??。它与
微粒中的质子数是??,中子数是??,核外电子数是??。它与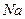 形成的化合物的电子式??,此化合物类型??(填“离子化合物”或“共价化合物”)。
形成的化合物的电子式??,此化合物类型??(填“离子化合物”或“共价化合物”)。
参考答案:16;18;16;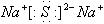 ;离子化合物?(每空1分)
;离子化合物?(每空1分)
本题解析:略
本题难度:简单