1、选择题 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应: CO(g)+H2O(g)?CO2+H2(g)?反应过程中测定的部分数据见下表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
|
下列说法不正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.20/t1mol?L-1?min-1
B.保持其他外界条件不变,若起始时向容器中充入1.20?mol?CO和1.20?mol?H2O,反应在t1min内的平均速率会增大
C.保持其他外界条件不变,按图表中的通入量,初始再多通入0.20mol氦气,则反应在t1min内的平均速率会增大
D.在t1到?t2时间段内,上述可逆反应已经达到平衡状态
参考答案:A.反应在t1min内的平均速率为v(H2)=v(CO)=1.20mol-0.80mol2Lt1=0.20/t1mol?L-1?min-1,故A正确;
B.体积不变,气体的物质的量增大,浓度增大,所以反应速率加快,即反应在t1min内的平均速率会增大,故B正确;
C.体积不变,多通入0.20mol氦气,反应体系中各物质的浓度不变,则反应速率不变,故C错误;
D.反应为吸热反应,温度越高,CO的含量越少,所以在t1到?t2时间段内,上述可逆反应已经达到平衡状态,故D正确;
故选C.
本题解析:
本题难度:一般
2、选择题 NO和CO都是汽车尾气里的有害物质,它们能缓慢反应,生成氮气和二氧化碳,对此反应,下列叙述正确的是( )
A.使用催化剂不改变反应速率
B.改变温度对反应速率无影响
C.升高温度能加快反应速率
D.使用催化剂能加快反应速率
参考答案:加入催化剂,可降低反应的活化能,增大活化分子的百分数,增大反应速率,升高温度,提高反应的活化能,反应速率增大,
故选CD.
本题解析:
本题难度:一般
3、填空题 (11分)Ⅰ.下列各项分别与哪个影响化学反应速率因素的关系最为密切?
⑴夏天的食品易变霉,在冬天不易发生该现象_________?
⑵同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢?
⑶MnO2加入双氧水中放出气泡更快______________。
Ⅱ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
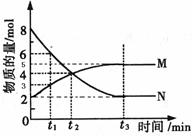
⑴比较t2时刻,正逆反应速率大小V正____ V逆。(填“>”、“=”、“<”)
⑵若t2 =2min,计算反应开始至t2时刻,M的平均化学反应速率为:________
⑶t3时刻化学反应达到平衡时反应物的转化率为_________
⑷如果升高温度则V逆____(填增大、减小或不变)
参考答案:Ⅰ.⑴温度(1分)⑵反应物本身性质(1分)⑶催化剂(1分)?
Ⅱ.⑴ V正> V逆(2分)⑵0.25 mol·L-1·min-1(2分)⑶75%(2分)⑷ V逆?增大(2分)
本题解析:Ⅰ.考查外界条件对反应速率的影响。
(1)夏天温度高,反应速率快,所以应该是温度。
(2)镁的活泼性强于锌的,反应速率快,所以应该是反应物本身性质。
(3)双氧水的分解反应中,二氧化锰其催化剂的作用。
Ⅱ.(1)根据图像可知,t2时刻反应物的浓度减小,生成物的浓度增加,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
(2)在t2时刻M的物质的量是4mol,所以M的变化量是4mol-2mol=2mol,因此其反应速率是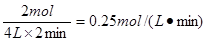 。
。
(3)t3时刻反应物N的物质的量是2mol,变化量是8mol-2mol=6mol,所以反应物的转化率为6÷8×100%=75%。
(4)升高温度反应速率都是增大的。
本题难度:一般
4、选择题 决定化学反应速率的主要原因是( )
A.参加反应物本身的性质
B.加入催化剂
C.温度和压强
D.各反应物和生成物的浓度
参考答案:影响化学反应速率的主要原因是反应物的性质,为内因,如Na、Mg分别与水的反应;一些不能发生的反应,即使加入催化剂或改变温度、压强、增大浓度等也不能反应,不是影响反应速率的主要因素.
故选A.
本题解析:
本题难度:简单
5、选择题 下列过程中,需要减慢化学反应速率的是( )
A.合成氨
B.炼钢
C.钢铁生锈
D.合成橡胶
参考答案:合成氨,炼钢、合成橡胶等,应增加反应速率,增大产量,钢铁的生锈,会导致材料浪费,应降低反应速率,
故选C.
本题解析:
本题难度:简单