1、填空题 反应进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
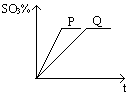
(1)如果两条曲线为其它条件相同,分别为使用和不使用催化剂,则曲线___________表示使用了催化剂,并且从图象可知,催化剂可以____________________,但不能__________________。
(2)请你再提出能增大该反应反应速率的两条措施______________和_________________。
参考答案:(1)P;增大反应速率;改变反应进行的方向
(2)升高温度;增大压强
本题解析:
本题难度:一般
2、选择题 对于可逆反应mA(g)+nB(g)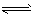 pC(g)+gD(g),若其他条件都不变,只是在反应前加入合适的催化剂,则两种v~t图像如下图;①a1=a2;②a1 <a2 ③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧右图阴影部分面积更大。以上正确的为
pC(g)+gD(g),若其他条件都不变,只是在反应前加入合适的催化剂,则两种v~t图像如下图;①a1=a2;②a1 <a2 ③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧右图阴影部分面积更大。以上正确的为
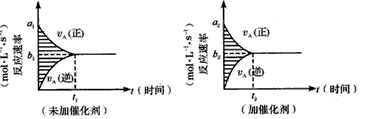
[? ]
A.②④⑤⑦
B.②④⑥⑧
C.②③⑤⑦
D.②③⑥⑧
参考答案:A
本题解析:
本题难度:一般
3、选择题 在一定条件下,可逆反应:N2+3H2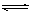 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
A.加催化剂,V(正)、V(逆)都发生变化且变化的倍数相等
B.加压,V(正)、V(逆)都增大,且V(正)增大的倍数大于V(逆)增大的倍数
C.降温,V(正)、V(逆)都减小,且V(正)减小的倍数小于V(逆)减小的倍数
D.加入氩气,V(正)、V(逆)都增大,且V(正)增大的倍数大于V(逆)增大的倍数
参考答案:D
本题解析:A、正确;B、加压,平衡正向移动,V(正)增大的倍数大于V(逆)增大的倍数,正确;C、降温,平衡正向移动,且V(正)减小的倍数小于V(逆)减小的倍数,正确;D、加入不反应的气体(容器体积不变),反应速率不变,平衡不移动,错误。
本题难度:一般
4、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是( )
A.加入少量醋酸钾固体
B.加入少量稀NaOH溶液
C.加入少量NH4HSO4固体
D.加入少量Na2CO3浓溶液
参考答案:A.加入少量CH3COOK固体,使盐酸转化为醋酸,减小氢离子的浓度,不改变氢离子的物质的量,可满足减缓反应速率但又不影响生成H2的总量,故A选;
B.因盐酸与NaOH溶液反应,会导致生成氢气的量减少,故B不选;
C.因为硫酸氢钠溶液中含有氢离子,会导致生成氢气的量增多,故C不选;
D.因为盐酸和碳酸钠溶液反应,会导致生成氢气的量减少,故D不选;
故选A.
本题解析:
本题难度:一般
5、填空题 某化学反应2A (g)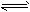 B(g)+D(g)在4种不同条件下进行,B和D的起始浓度为0,反应物A的浓度
B(g)+D(g)在4种不同条件下进行,B和D的起始浓度为0,反应物A的浓度
(mol·L-1) 随反应时间(min)的变化情况如下表
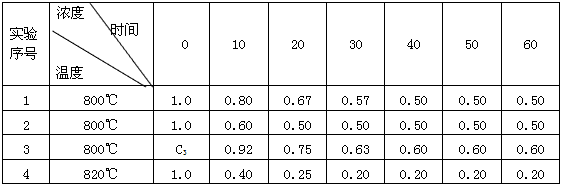
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是___________min,实验4达到平衡的时间是____________min,C3______
1.0 mol·L-1(填“ < ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率__________(填“快”或“慢”),原因是_____________________。
参考答案:(1)40;30;>?
(2)快;升高温度,反应速率加快
本题解析:
本题难度:一般