1、选择题 设C+CO2==2CO;△H>0,反应速率为v1;N2+3H2==2NH3;△H<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为……( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
2、简答题 下表数据是某科研机构在某温度下测得的金属镁、锌和镍分别在氧气中进行氧化反应时,金属表面生成氧化物薄膜的实验数据记录:
| 反应时间t(h) | 1 | 4 | 9 | 16 | 25
MgO膜厚Y(nm)
0.02a
0.08a
0.18a
0.32a
0.50a
ZnO膜厚Y(nm)
1.0×10-3b
4.0×10-3b
9.0×10-3b
1.6×10-2b
2.5×10-2b
NiO膜厚Y(nm)
0.3c
0.6c
0.9c
1.2c
1.5c
|
(说明:a、b、c均为与温度有关的常数)
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:______;ZnO:______.
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:______.
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是______.
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性:______.
3、实验题 某探究小组用测量HNO3与大理石反应过程中因二氧化碳逸出质量减小的方法,研究影响反应速率的因素。限选试剂:(实验过程中不考虑稀硝酸的挥发)
1.0mol·L-1 HNO3、2.0mol·L-1 HNO3、细颗粒大理石、粗颗粒大理石、35 ℃水浴
(1)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
实验编号
| T/℃
| 大理石规格
| HNO3浓度/mol·L-1
|
①
| 常温
| 粗颗粒大理石
| ?
|
②
| 常温
| 粗颗粒大理石
| 2.0
|
③
| ?
| 粗颗粒大理石
| 2.0
|
④
| 常温
| ?
| 2.0
|
?
以上表格中实验①、③、④空格处应填?、?、?。
(2)整个实验中应控制的不变量是硝酸溶液体积和?。
(3)该实验小组用如图实验装置进行实验。
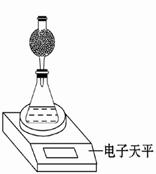
①除电子天平、干燥管、胶头滴管、秒表、玻璃棒、锥形瓶、药匙、胶塞等仪器外,必需的玻璃仪器还有?。
②干燥管中应放置的试剂是?。
A.碱石灰? B.无水CaCl2固体
C.生石灰?D.浓硫酸
③若撤除干燥管装置,所测速率?(填“偏大”、“偏小”或“不变”)。
4、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
A.加入少量稀NaOH溶液
B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体
D.加入少量Na2CO3浓溶液
5、选择题 下列说法正确的是(?)
A.增大压强,化学反应速率一定增大
B.化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少
C.升高温度,化学反应速率一定增大
D.加入反应物,化学反应速率增大