1、选择题 下列反应是吸热反应的是(?)
A.铝片与稀硫酸反应
B.甲烷在氧气中燃烧
C.NaOH溶液和稀盐酸
D.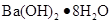 与
与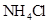 的反应
的反应
参考答案:D
本题解析:A:活泼金属与酸反应放出氢气都是放热反应;B:燃烧反应都是放热反应;C:酸碱中和反应是放热反应;D: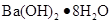 溶于水几乎不放热,
溶于水几乎不放热,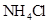 溶于水要吸大量的热,故此反应的吸热反应,故选D。
溶于水要吸大量的热,故此反应的吸热反应,故选D。
点评:对课本基础内容的考查,需熟记常见反应属于放热反应,还是吸热反应,属于基础题。对于反应化学能的考查,在高考中主要以考查反应热的计算为主。
本题难度:简单
2、选择题 下列反应是吸热反应的是
A.液态水汽化
B.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
C.铝和盐酸的反应
D.灼热的炭与氧气反应
参考答案:B
本题解析:A是物理变化,吸热,但不是吸热反应。C、D都是放热反应,B是吸热反应,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对常见放热反应和吸热反应的了解情况,意在巩固学生的基础知识,提高学生的应试能力。该题的关键是记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。另外该题还需要注意的是物理变化中的热效应不能是放热反应或吸热反应。
本题难度:简单
3、填空题 (6分)如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。
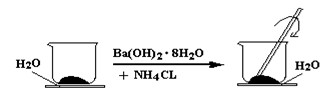
 (1)实验中要用玻璃棒搅拌的原因是?
(1)实验中要用玻璃棒搅拌的原因是?
 ?(2)写出有关反应的化学方程式:?,
?(2)写出有关反应的化学方程式:?,
该反应?(填“是”或“不是”)氧化还原反应。&s.5*u.c.#om
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
 ?。
?。
(4)通过最后一个现象可以说明该反应为_________(填“吸”或“放”)热反应,这是由于反应物的总能量_________(填“大于”或“小于”)生成物的总能量。
参考答案:
(1)该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应
(2) Ba(OH)2·8H2O +2NH4Cl = BaCl2 +2NH3↑ +10 H2O?不是
(3) 玻璃片上因结冰而与小烧杯粘在一起
(4) 吸,小于
本题解析:略
本题难度:简单
4、选择题 下列图像分别表示有关反应的反应过程与能量变化的关系

据此判断下列说法中正确的是(?)
A.白磷比红磷稳定
B.石墨转变为金刚石是吸热反应
C.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2则△H1>△H2
D.CO(g)+H2O(g)=CO2(g)+ H2 (g);△H1>0
参考答案:B
本题解析:A、由题给图像知,白磷具有的能量比红磷高,物质具有的能量越低越稳定,红磷比白磷稳定,错误;B、由题给图像知,金刚石具有的能量比石墨高,则石墨转变为金刚石是吸热反应,正确;C、由题给图像知,S(g)燃烧放出的热量比S(s)燃烧放出的热量多,则△H1<△H2,错误;D、由题给图像知,CO(g)+H2O(g)=CO2(g)+ H2 (g)为放热反应,△H1<0,错误。
本题难度:一般
5、填空题 二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s)?△H1="a" kJ·mol-1
NH2CO2NH4(s)?△H1="a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)?△H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g)?△H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)?△H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g)?△H3=-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1=__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅱ的△S______(填>或<)0,一般在__________情况下有利于该反应的进行。
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是________(填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________。

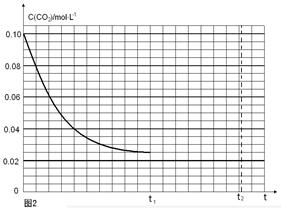
(4)反应Ⅰ的平衡常数表达式K1=____________________;如果起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,平衡常数K1将__________(填增大、减少、不变)。
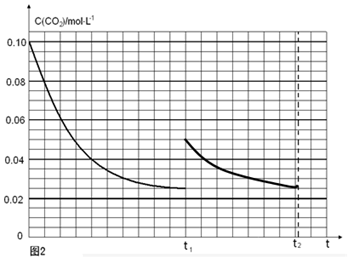
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
A.NH2COONH4
B.H2NOCCH2CH2CONH2
C.HOCH2CH2OH
D.HOCH2CH2NH2
参考答案:(14分)(1)-159.47(2分)?(2)>(1分)?高温(1分)
(3)①降低(1分)②温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低,(2分,给出合理解释即可给分)。
(4)K?1=1/[c2(NH3)·c(CO2)] (2分),减少(1分)
(5)
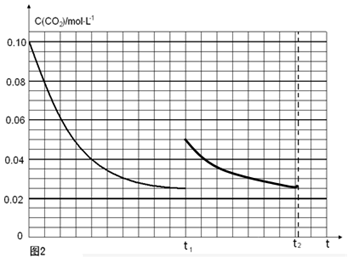 (注意:曲线的起点、平衡点和变化趋势共2分)
(注意:曲线的起点、平衡点和变化趋势共2分)
(6)A、B(2分)
本题解析:解:(1)反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s)△H1="a" kJ·mol-1
NH2CO2NH4(s)△H1="a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1
由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g) NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1,
NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1,
故答案为:-159.47;
(2)反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:>;高温;
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:>;高温;
(3)①反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=
NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=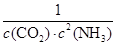 ?;
?;
起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,反应是放热反应,随反应进行温度升高平衡逆向进行,平衡常数减小;
(5)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g) NH2CO2NH4(s)
NH2CO2NH4(s)
起始量(mol·L-1)? 0.2? 0.1? 0
变化量(mol·L-1) 0.15? 0.075
平衡量(mol·L-1) 0.05? 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol·L-1,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
 ;
;
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:
(NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:
A.NH2COONH4,结构中含有与羰基连接的氨基,故A符合;
B.H2NOCCH2CH2CONH2结构中含有与羰基连接的氨基,故B符合;
C.HOCH2CH2OH,结构中不含有氨基,故C不符合;?
D.HOCH2CH2NH2,分子中的氨基不是和羰基连接,不具备次性质,故D不符合;
故答案为:A、B。
本题难度:一般