1、填空题 (12分)A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。
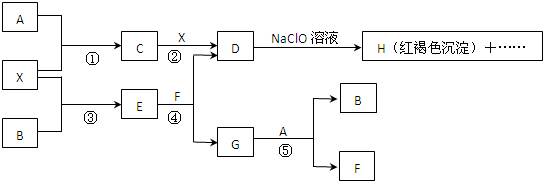
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤ 反应中肯定不属于氧化还原反应的是 (填编号);
反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置: ?;
(4)请写出反应④和⑤的离子方程式:④ ,
⑤ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
。
参考答案:(12分)
(1) FeCl3 (2) 4 ?(3) 四 VIII
(4) FeS+2H+=Fe2++H2S↑ H2S+ Cl2=S+2H++2Cl-
(5)2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl- 或 6Fe2++3ClO-+3H2O=2Fe(OH)3+3Cl-+4 Fe3+
本题解析:略
本题难度:一般
2、推断题 下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2:1 ,化合物X、Y、A、D、E、G的焰色反应为黄色,I是白色沉淀。
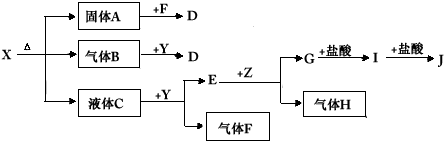
(1)写出X、E、I的化学式。X___________E____________I_____________。
(2)写出Y的电子式___________________。
(3)关于Y的说法正确的是_____________。
A.Y是氧化物
B.Y是过氧化物
C.Y是含有非极性键的离子化合物
D.Y是碱性氧化物
(4)写出B和Y反应的化学方程式:_____________________________。
(5)X和G的溶液能反应吗?如能反应,写出反应的离子方程式;如不能反应,请说明理由:
____________________________________
参考答案:(1)X:NaHSO3;E:NaOH;I:Al(OH)3
(2)
(3)ABC
(4)Na2O2+SO2==Na2SO4
(5)HSO3-+AlO2-+H2O==SO42-+Al(OH)3↓
本题解析:
本题难度:困难
3、推断题 图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。?
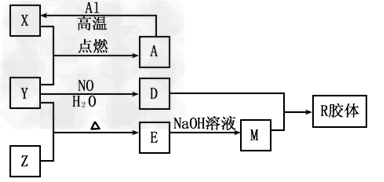
?回答下列问题:
(1)元素X在元素周期表中的位置为第________周期________族。
(2)一定条件下,Z能与H2反应生成ZH4?,写出Z与NaOH反应的化学方程式__________
(3)写出由Y与NO、H2O生成D反应的化学方程式:_____________。
(4)X在高温下能与水蒸气反应,请写出该反应的化学方程式:___________
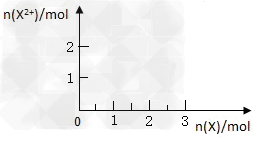
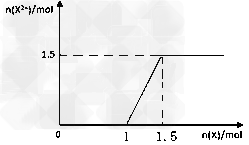
(5)向含4mol?D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
参考答案:(1)四 ;Ⅷ
(2)Si?+?2NaOH?+?H2O?=Na2SiO3?+?2H2↑;
(3)4NO+3O2+2H2O=4HNO3?
(4)3Fe+4H2O(g)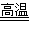 Fe3O4+4H2?
Fe3O4+4H2?
(5)
本题解析:
本题难度:一般
4、填空题 (10分)下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)B的电子式为??;
(2)写出B和C反应的化学方程式?;
(3)写出E与G的稀溶液的离子方程式,写出电子转移数目:?,?;
(4)汽车尾气中常含有D和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:F(g) + A(g) =" 2D" (g) ;△H =" +180.5KJ/mol"
2C (s)+ O2 (g)=" 2CO(g)" ;△H =" -221.0" KJ/mol
C (s)+ O2(g) = CO2(g);△H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为:?。
参考答案:
(1)NH3;(略)
(2)3CuO + 2NH3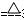 3Cu + N2 +3H2O(加热)
3Cu + N2 +3H2O(加热)
(3) 3Cu +8H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O? 6e-
(4)2NO(g)+2CO(g) 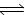 N2(g)+2CO2(g);△H= —746.5KJ/mol
N2(g)+2CO2(g);△H= —746.5KJ/mol
本题解析:略
本题难度:简单
5、简答题 A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性.F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末.这些物质之间满足如下图所示的转化关系,图中部分生成物已略去.

(1)写出下列物质的化学式:A______,F______.
(2)B的电子式是______.根据图中信息,B、C、X的氧化性由强到弱的顺序是______(用化学式表示).
(3)反应⑥的离子方程式是______.
(4)在反应⑥中,F表现的性质是______,当生成0.75molC时,被氧化的还原剂的物质的量是______.
参考答案:B、D为液体,其中B的分子为4原子分子,因此B是H2O2,D在常温下不具有挥发性,且D能和铜反应,这说明D应该是H2SO4,则根据A是气体可知A是SO2,F的浓溶液与X共热通常用于实验室制备单质C,且C、E、F为气体,由于H2O2易分解生成O2,这说明E应该是O2,则X就是MnO2,所以C是Cl2,F是HCl,
(1)由以上分析可知A为SO2,F为HCl,故答案为:SO2;HCl;
(2)B是H2O2,为共价化合物,电子式为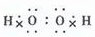 ,根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2,故答案为:
,根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2,故答案为: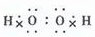 ;MnO2>Cl2>H2O2;
;MnO2>Cl2>H2O2;
(3)反应⑥是实验室制取氯气,反应的离子方程式是MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O;
(4)在实验室制取氯气的反应中,浓盐酸表现出的性质是还原性和酸性.根据氯原子守恒可知,当生成0.75mol 氯气时,被氧化的还原剂的物质的量是0.75mol×2=1.5mol,
故答案为:还原性、酸性;1.5mol.
本题解析:
本题难度:简单