1、填空题 如图所示,已知:
①甲、乙、丙、丁四种元素均是前18号元素的单质;
②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成X和Y,在产物中元素甲显负价;
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中乙显负价.
请填空:(1)甲是______,乙是______.
(2)甲与丙反应生成X的化学方程式是______.
(3)乙与丁反应生成W的化学方程式是______.
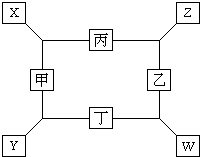
参考答案:在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,产物中元素甲显负价,说明反应后甲的化合价为-3价或-3n(n为正整数),由前18号元素的常见价态可知,反应后甲的化合价为-3价,甲为N2;与N21:3反应的单质有H2、Mg,丙与丁是H2和Mg.在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,产物中乙显负价,说明反应后乙的化合价为-2价或-2n(n为正整数),由前18号元素的常见价态可知,反应后甲的化合价为-2价.甲为O2或S,O2与H2、Mg都可都按物质的量之比1:2反应,但S与H2、Mg反应时,他们的物质的量之比是1:1,因而乙是O2.由于丙、丁不能确定谁是H2或Mg,所以甲与丙反应生成X的化学方程式是N2+3Mg=Mg3N2或N2+3H2=NH3;乙与丁反应生成W的化学方程式是O2+2H2=2H2O或2Mg+O2=2MgO;
(1)分析判断可知,甲为N2,乙为O2 ,故答案为:N2;O2;
(2)甲与丙反应生成X的反应可以是氮气和镁的反应,也可以是氮气和氢气的反应,反应的化学方程式是N2+3Mg点燃.Mg3N2(N2+3H2催化剂.高温高压NH3),
故答案为:N2+3Mg点燃.Mg3N2(N2+3H2催化剂.高温高压NH3);
(3)乙与丁反应生成W的反应是氧气和氢气的反应或镁和氧气反应生成氧化镁的反应,反应的化学方程式是O2+2H2点燃.2H2O(2Mg+O2点燃.2MgO),
故答案为:O2+2H2点燃.2H2O(2Mg+O2点燃.2MgO).
本题解析:
本题难度:一般
2、填空题 在一定条件下,某些化学反应可以用如图框架表示,根据要求回答下列问题:
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式______;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为______
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式______
(4)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,
写出符合上述框图关系的离子方程式______.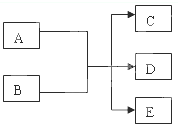
参考答案:(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,说明发生了氧化还原反应中的歧化反应,所以推断A为Cl2,B为NaOH,D具有漂白性,判断D为次氯酸钠,C为氯化钠,E为水;反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)通过电解的方法获得黄绿色气体C,判断C为Cl2,反应是电极饱和食盐水的反应,反应的 离子方程式为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-;
(3)若C、D均为气体且均能使澄清石灰水变浑浊,判断气体为二氧化碳和二氧化硫,符合上述框图要求的化学方程式为碳和浓硫酸加热的反应,反应化学方程式为:
则判断AB为碳和浓硫酸的反应,反应的化学方程式为:C+2H2SO4(浓)?△?.?CO2↑+SO2↑+2H2O,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+SO2↑+2H2O;
(4)A为红色金属单质判断为Cu,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,能和铜反应证明是稀硝酸;铜与稀硝酸的反应离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
本题解析:
本题难度:简单
3、填空题 (10分)下图中A~I分别代表有关反应中的一种物质,其中A为酸式盐,请回答下列问题:
 (1)A、F的化学式分别为?、??。?
(1)A、F的化学式分别为?、??。?
(2)I的电子式为?;I的沸点较高的原因是?
(3)E的水溶液中,各离子浓度由大到小的顺序为
?。
(4)写出反应B+Na2O2?→? D+E的化学方程式:
?
(5)指出实验室中保存H的方法及其原因:?
参考答案:(1)NH4HCO3? NO
(2)H? O? H? 存在分子间氢键
(3)c (Na+)>c(CO 32-? )>c(OH-)>c(HCO 3- ?)>c(H+)
(4)2CO2+2Na2O2 =2Na2CO3+O2
(5)硝酸见光或受热容易分解,故通常保存在棕色瓶中并置于冷暗处
本题解析:本题是无机框图题,关键是找准突破点。框图中有两条重要信息:一是B经浓H2SO4干燥后可与过氧化钠反应,可以推知B可能为二氧化碳;二是A为酸式盐,加热后固体完全消失得到混合气体,可以推知A为弱酸酸式铵盐,则C为NH3,C与D能发生催化反应,故D为O2,E为Na2CO3。其余物质依次为A:NH4HCO3,F:NO,I:H2O,G:NO2。H:HNO。
本题难度:一般
4、填空题
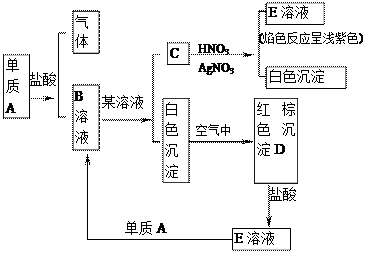
根据图指出A、B、C、D、E各是什么物质?
参考答案:A、Fe? B、FeCl2?C、KCl? D、Fe(OH)3, E、FeCl3
本题解析:
在该题中有以下突破口:①C中加入硝酸酸化的AgNO3有白色沉淀,推断C中含Cl-,E溶液焰色反应呈浅紫色,推断C中含K+,则C是KCl。②白色沉淀在空气中放置变成红褐色沉淀D,可以推断D是Fe(OH)3,E是FeCl3,进而可以推断A是Fe,B是FeCl2。
本题难度:一般
5、填空题 A. A、B、C、D、E、F为原子序数依次增大的短周期主族元素。 A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
⑴写出B的基态原子的核外电子排布式?。
⑵A、C形成的最简单分子极易溶于水,其主要原因是?;与该最简单分子互为等电子体的阳离子为?。
⑶比较E、F的第一电离能:E?F(选填“>”或“<”)。
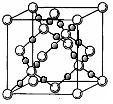
⑷BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于?(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为?。
⑸光谱证实单质F与强碱性溶液反应有[F(OH)4]—生成,则[F(OH)4]—中存在?。
a.共价键? b.非极性键? c.配位键? d.σ键? e.π键
B.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设?①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是?。
⑵设计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
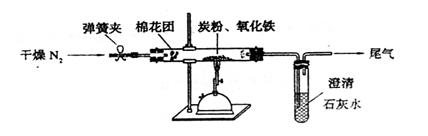
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式:?。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为?。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
?。
⑹实验优化?学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是?。
②从环境保护的角度,请你再提出一个优化方案:?。
参考答案:A.⑴1s22s22p2?⑵NH3与H2O间能形成氢键? H3O+?⑶>?⑷原子? sp3?⑸acd
(第⑷小题每空1分,其余每空2分,共12分)
B.⑴CO2、CO的混合物?⑶NH4++NO2—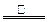 N2↑+2H2O
N2↑+2H2O
⑷步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3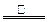 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
⑹①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小。
②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
(每空2分,共12分)
本题解析:略
本题难度:一般