1、选择题 某同学根据原电池原理设计了“苹果电池”(如图),下列有关说法中正确的是( )
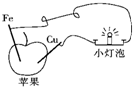
A.苹果里有电解质溶液
B.铁片是此“苹果电池”的正极
C.将苹果换成番茄,小灯泡就不亮了
D.一段时间后取出Cu片,其质量减少
参考答案:A、两个电极插入苹果,灯泡发亮,说明形成了原电池反应,苹果中有电解质溶液,故A正确;
B、铁和铜做原电池电极,铁做负极,故B错误;
C、番茄中也含有电解质溶液,灯泡也会发亮,故C错误;
D、铜片做原电池正极,不反应,质量不变,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 下列关于原电池的叙述正确的是
[? ]
A.原电池将化学能转化为电能
B.原电池负极发生的反应是还原反应
C.原电池在工作时其正极不断产生电子并经过外电路流向负极
D.原电池的电极只能由两种不同的金属构成
参考答案:A
本题解析:
本题难度:简单
3、选择题 (2004年江苏高考化学题)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
参考答案:A、根据总反应可知Zn被氧化,为原电池的负极,故A正确;
B、根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,
为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为
2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故B正确;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、负极反应为Zn-2e-+2OH-═Zn(OH)2,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量
为0.1mol×65g/mol=6.5g,故D正确.
故选C.
本题解析:
本题难度:一般
4、选择题 一种新型燃料电池,是用两根金属铂作电极插入KOH溶液中,然后向两极上分别通入H2和O2,下列说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为2H2O+O2+4e-4OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6LO2完全反应后有1mol电子转移
参考答案:A、氢氧燃料电池中通入氢气的一极为原电池的负极,故A正确;
B、氢氧燃料电池中通入氧气的一极为原电池的正极,发生还原反应,在碱性电解质环境下的电极反应为:2H2O+O2+4e-4OH-,故B正确;
C、碱性氢氧燃料电池中,电池的负极反应为2H2+2OH-=2H2O+2e-,因为消耗氢氧根离子,导致负极附近pH下降,故C错误;
D、氢氧燃料电池总反应为2H2+O2=2H2O,参加反应的氧气的物质的量是1mol时,转移电子是4mol,通入5.6L即0.25molO2完全反应后有1mol电子转移,故D正确.
故选C.
本题解析:
本题难度:简单
5、填空题 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
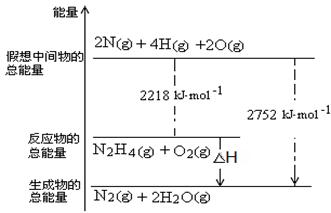
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为?。
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式?。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:?

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1
B.w3=w1
C.2ρ1=ρ2
D.K甲= K乙= K丙