1、选择题 在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应A(s)+2B(g) C(g)+D(g)已达到平衡的是
C(g)+D(g)已达到平衡的是
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体总的物质的量
参考答案:BC
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确。根据方程式可知,反应前后体积都是不变的,所以压强和气体的总的物质的量都是不变的,AD都不正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体质量是变化的,B正确。答案选BC。
本题难度:一般
2、填空题 (每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应: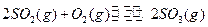
(1)若开始时通入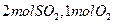 ,达平衡时生成
,达平衡时生成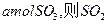 的转化率为?。
的转化率为?。
(2)若开始时通入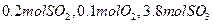 ,达平衡时SO2的物质的量为?mol。
,达平衡时SO2的物质的量为?mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是?。
参考答案:(1)50 a%?(2)4-2a?(3)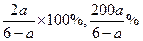
本题解析:略
本题难度:简单
3、选择题 可逆反应2SO2+O2 2SO3达到平衡的标志是( )。
2SO3达到平衡的标志是( )。
①消耗2 mol SO2的同时生成2 mol SO3 ②SO2、O2与SO3的物质的量之比为2∶1∶2 ③反应混合物中,SO3的质量分数不再改变
A.①②
B.①③
C.③
D.①
参考答案:C
本题解析:①只提到正反应速率;②各物质的物质的量之比为2∶1∶2,若为瞬时,不一定平衡,如保持不变,则平衡;③SO3的质量分数不再改变,即说明各物质浓度不再改变,反应达到平衡。
本题难度:简单
4、计算题 某温度下在密闭容器中发生如下反应:
2M(g)+N(g) 2E(g)
2E(g)
开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为多少?
参考答案:60%
本题解析:充入2 mol E建立的平衡状态与只充入2 mol M和1 mol N建立的平衡状态是完全相同的,所以,计算出E的转化率即可知道M的转化率。设达平衡时生成N的物质的量为x。
2M(g)+N(g) 2E(g)
2E(g)
起始? 0? 0? 2 mol
变量? 2x? x? 2x
平衡? 2x? x? 2 mol-2x
2x+x+2 mol-2x="2" mol+2 mol×20%
x="0.4" mol
E的转化率=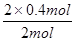 ×100%=40%
×100%=40%
故M的转化率为60%。
本题难度:简单
5、填空题 (13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡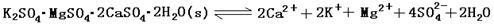
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
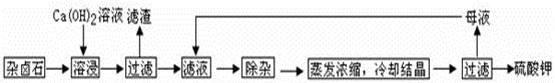
(1)滤渣主要成分有?和?以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:?。
(3)“除杂”环节中,先加入?溶液,经搅拌等操作后,过滤,再加入?溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,?
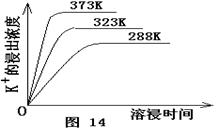
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5?,求此温度下该反应的平衡常数K?。
参考答案:(1)CaSO4(1分) Mg(OH)2(1分)
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(2分)
(3)K2CO3 (2分)?H2SO4 (2分)
(4)①③(2分)
(5)K=1.75×104(3分)
本题解析:(1)根据题目给出的可逆溶解平衡,加Ca(OH)2后,Mg 2+变成Mg(OH)2,硫酸钙是微溶物,因此滤渣成分是Mg(OH)2,CaSO4和未溶杂卤石;(2)根据勒夏特列原理,加入Ca(OH)2后,Mg 2+不断沉淀,硫酸钙也析出,平衡正移,因此浸出K+;(3)为了使生成的硫酸钾最纯,要除去加入的过量的氢氧化钙,而进入杂质阳离子,因此加入碳酸钾,最后硫酸钾除去过量的碳酸钾且调节溶液pH值;(4)由已知曲线图观察可知,升高温度可以提高K+浸出率,缩短浸出时间;(5)由题意知:Ksp(CaCO3)=2.80×10-9=c(Ca2+)·c(CO32-),Ksp(CaSO4)=4.90×10-5=c(Ca2+)·c(SO42-),因此有:Ksp =1.75×104。
点评:本题在化学工艺流程的背景下对化学反应平衡进行考查,题目难度比较大,综合性较强。
本题难度:一般