1、选择题 下列说法错误的是( )
A.催化剂是通过降低反应所需的活化能来增大反应速率的
B.对于有气体参加的反应,压强增大,单位体积内的活化分子数增多,发生有效碰撞的机会增多,反应速率加快
C.发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞
D.光、电磁波、超声波等因素会对反应速率产生影响
参考答案:A.催化剂可降低反应的活化能,增大活化分子的百分数,从而增大反应速率,故A正确;
B.增大压强,浓度增大,则单位体积内的活化分子数增多,发生有效碰撞的机会增多,反应速率加快,故B正确;
C.只有活化分子发生有效碰撞,发生有效碰撞时取决于分子的能量和碰撞方向,故C错误;
D.光、电磁波、超声波等也影响化学反应速率,如硝酸、次氯酸在光照条件下发生分解,故D正确.
故选C.
本题解析:
本题难度:一般
2、选择题 少量铁粉与100ml?0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O?②加NaOH固体?③滴入几滴浓盐酸?④加CH3COONa固体⑤加NaCl溶液?⑥滴加几滴硫酸铜溶液?⑦升高温度(不考虑盐酸挥发)⑧改用10ml?0.1mol/L的盐酸.
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③⑥⑦⑧
参考答案:①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,反应速率加快;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量;
⑦升高温度,反应速率加快;
⑧改用浓度大的盐酸,反应速率加快.
故选C.
本题解析:
本题难度:简单
3、选择题 下列说法正确的是( )
A.分子的每一次碰撞都能够发生化学反应
B.反应物用量增加后,有效碰撞次数增多,反应速率增大
C.能够发生有效碰撞的分子叫做活化分子
D.加入催化剂对化学反应速率无影响
参考答案:A.分子发生有效碰撞时才能发生化学反应,故A错误;
B.反应物用量增加后,有效碰撞次数增多,但单位体积的有效碰撞不一定增大,即浓度不一定增大,如加入固体或纯液体,故B错误;
C.分子发生有效碰撞时发生化学反应,此时的分子为活化分子,故C正确;
D.加入催化剂可降低活化能,提高活化分子的百分数,反应速率增大,故D错误.
故选C.
本题解析:
本题难度:简单
4、计算题 在一个容积不变的反应器中,要求调节体系的温度使下列反应达到平衡时,保持容器内气体的总物质的量为12 mol。
已知反应A(g)+2B(g) 2C(g),现向容器中加入6.5 mol A、x mol B、2.0 mol C。
2C(g),现向容器中加入6.5 mol A、x mol B、2.0 mol C。
(1)若x=5.5时,需要降低体系的温度使反应在平衡时达到题设条件,则正反应为_______(填“吸热”或“放热”)反应。
(2)欲使起始反应维持向逆反应方向进行,则x的取值范围为_________。
(3)在一定温度下的上述平衡体系中,另按1∶2 的物质的量之比通入D和E两种气体(此时容器内气体的总物质的量不要求保持12 mol),按下式反应:D(g)+E(g) 2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入m mo l D,n mol F和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为________mol(设A、B、C与D、E、F之间均不反应)。
2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入m mo l D,n mol F和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为________mol(设A、B、C与D、E、F之间均不反应)。
参考答案:(1)放热(2)2.5<x<3.5
(3)2m+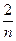
本题解析:(1)? A(g)? +? 2B(g) 2C(g)
2C(g)
起始/mol? 6.5? x?2
平衡n总="12" mol
当x=5.5时,6.5+5.5+2=13>12,降温使平衡向右移动,使n总="12" mol,故正反应为放热反应。
(2)若维持反应向逆反应方向进行,则有:
6.5+x+2<12,所以x<3.5。
设C转化了a? mol则:
A(g)? +? 2B(g) 2C(g)
2C(g)
起始6.5? x? 2
平衡6.5+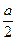 ? x+a? 2-a
? x+a? 2-a
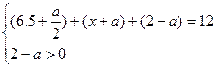
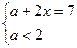 ?所以x>2.5
?所以x>2.5
故x的取值范围是2.5<x<3.5。
(3)另有反应:D(g)? +? E(g) 2F(g)
2F(g)
起始:? m? n(E)? n
新平衡:(m+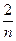 )∶[n(E)+
)∶[n(E)+ 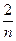 ]=1∶2。
]=1∶2。
由于是等体积反应,保持(m+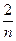 )∶[n(E)+
)∶[n(E)+ 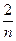 ]=1∶2即可,n(E)=2m+
]=1∶2即可,n(E)=2m+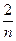 。
。
本题难度:简单
5、选择题 下列反应中符合下图图像的是
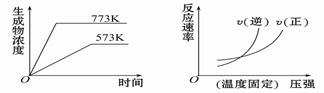
A.N2(g) + 3H2(g)  2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0)
2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0)
B.2SO3(g)  2SO2(g) + O2(g)ΔH =" +" Q2 kJ·mol-1 (Q2>0)
2SO2(g) + O2(g)ΔH =" +" Q2 kJ·mol-1 (Q2>0)
C.4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)ΔH =-Q3 kJ·mol-1 (Q3>0)
4NO(g) + 6H2O(g)ΔH =-Q3 kJ·mol-1 (Q3>0)
D.H2(g) + CO(g)  C(s) + H2O(g)ΔH =" +" Q4 kJ·mol-1 (Q4>0)
C(s) + H2O(g)ΔH =" +" Q4 kJ·mol-1 (Q4>0)