1、实验题 (12分)某同学为了探究锌与硫酸反应过程中的速率变化,他在100mL稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
| 1
| 2
| 3
| 4
| 5
|
氢气体积(mL)(标准状况)
| 50
| 120
| 232
| 290
| 310
|
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大______________,原因是______________________________________________。
(2)哪一时间段的反应速率最小________________,原因是___________________。
(3)求2~3分钟时间段以硫酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)______________________________________________________。
(4)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①上述实验中涉及到的离子反应方程式有??
?;
②硫酸铜溶液可以加快氢气生成速率的原因是?;
③实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4?溶液起相似作用的是?;
④该同学通过实验进一步研究了硫酸铜的量对氢气生成速率的影响。该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
?。
2、选择题 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
[? ]
A.盐酸的浓度
B.铝条的表面积
C.溶液的温度
D.加少量Na2SO4固体
3、填空题 (10分)把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
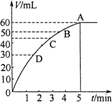
(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)A、B、C、D各点反应速率由快到慢的顺序是 。
(4)根据曲线形状解释反应速率变化的原因 。
(5)计算反应前过氧化氢的物质的量浓度
4、选择题 下列措施中肯定能使化学反应速率增大的是
[? ]
A.增加反应物的量?
B.增大反应体系的压强 ?
C.降低反应体系的温度?
D.使用适宜的催化剂
5、选择题 对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
A.v正 增大,v逆减小
B.v正减小,v逆增大
C.v正和v逆同程度的减小
D.v正和v逆不同等程度的减小