1、选择题 下列叙述正确的是
①冰岛和印度尼西亚火山喷发,火山灰在空气中几周都不能沉降,可能与胶体的性质有关.
②1mol葡萄糖可水解生成2mol乳酸(C3H6O3)
③简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性
④电解质溶于水,是在电流作用下离解成自由移动的离子
⑤金属A投入金属B的盐溶液中,A溶解则A的还原性强于B.
A.①②③⑤
B.①⑤
C.①③⑤
D.①③
参考答案:D
本题解析:分析:①胶体的胶粒带同种电荷有介稳性;
②1mol葡萄糖 2mol乳酸,转化过程中无其它反应物、生成物;
2mol乳酸,转化过程中无其它反应物、生成物;
③简单非金属阴离子一般都是最低价态,因而只有还原性.而金属阳离子可以有中间价态,故不一定只有氧化性;
④电解质的电离不需要通电条件;
⑤金属铜投入金属铁的盐溶液中,铜溶解但铜的还原性弱于铁.
解答:①火山灰在空气中形成胶体,胶粒带同种电荷,同种电荷相互排斥,胶体较稳定,故①正确;
②1mol葡萄糖C6H12O6,含6molC,12molH,6molO,可发酵转化为2mol乳酸,所以1mol乳酸中含3molC,6molH,3molO,则乳酸的分子式为C3H6O3,所以1mol葡萄糖可发酵生成2mol乳酸,转化过程中没有水作为反应物,故②错误;
③简单非金属阴离子一般都是最低价态阴离子,只有还原性;金属阳离子不一定只有氧化性,例如Fe2+既有氧化性又有还原性,故③正确;
④电解质是在水溶液中被水分子作用电离或熔融状态下电离与通电无关,故④错误;
⑤金属A投入金属B的盐溶液中,A溶解,则A的还原性不一定强于B,如由2FeCl3 +Cu=2FeCl2+CuCl2可知,铜溶解在铁的盐溶液中,但铜的还原性弱于铁,故⑤错误;
故选D.
点评:本题考查胶体性质、氧化还原、电解质的电离等,注意相关基础知识的积累,题目难度不大.
本题难度:困难
2、选择题 下列仪器一般不用作反应容器的是
A.量筒
B.烧杯
C.烧瓶
D.试管
参考答案:A
本题解析:分析:不能用作化学反应容器即不能在该仪器内进行化学反应,根据各种仪器的使用规则,进行分析判断.
解答:A.量筒,用于量取一定体积液体,不可用于反应容器,故A正确;
B.烧杯,可用于需要较大量溶液的反应的反应容器,故B错误;
C.烧瓶可用于固液或液液的反应容器,也可用于加热,故C错误;
D.试管可用于少量物质的反应容器,故D错误.
故选A.
点评:本题主要考查仪器的用途,难度不大,掌握常用仪器的用途是解题的先决条件.
本题难度:简单
3、选择题 下列药品能存放在同一橱柜中的是
①NaOH?②浓硫酸?③浓盐酸?④KMnO4? ⑤活性炭?⑥甲苯?⑦苯酚?⑧KClO
A.⑤和⑧、④和⑧
B.②和③、①和②
C.②和③、⑥和⑦
D.④和⑤、④和⑥
参考答案:C
本题解析:分析:在化学药品的保存中,一般根据物质的类别来保存,便于取用,根据酸碱不能混放,易燃物质不与氧化剂、易爆剂混放的存放原则.
解答:根据酸碱不能混放,易燃物质不与氧化剂、易爆剂混放的存放原则,氢氧化钠不能与浓硫酸、浓盐酸和苯酚混放,活性炭不能与高锰酸钾、甲苯、氯酸钾等混放,故选C.
点评:本题考查化学试剂的存放,学生应明确分类是一种科学的学习方法,在平时的学习和化学药品的保存中分类法都有重要的作用.
本题难度:一般
4、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,1mol氦气含有2NA个核外电子
B.常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换出22.4LH2
C.1?mol?Cl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1?L水中,Na+的物质的量浓度为1?mol?L-1
参考答案:A
本题解析:分析:A、氦气是单原子分子;
B、常温常压下,当活泼金属转移2NA个电子时,生成氢气物质的量为1mol,但体积不是2.24L;
C、1?mol?Cl2参加反应,可以是自身氧化还原反应,也可以是氯气做氧化剂,转移电子数不一定为2NA;
D、含NA个Na+的Na2O物质的量为0.5mol,溶解于1?L水中反应生成氢氧化钠溶液,溶质物质的量为1mol,溶液体积不是1L,所以物质的量难度不是1mol?L-1 .
解答:A、氦气是单原子分子;1mol氦气含有2NA个核外电子,故A正确;
B、常温常压下,当活泼金属转移2NA个电子时,生成氢气物质的量为1mol,但体积不是2.24L;故B错误;
C、1?mol?Cl2参加反应,可以是自身氧化还原反应,也可以是氯气做氧化剂,转移电子数不一定为2NA;故C错误;
D、含NA个Na+的Na2O物质的量为0.5mol,溶解于1?L水中反应生成氢氧化钠溶液,溶质物质的量为1mol,溶液体积不是1L,所以物质的量难度不是1?mol?L-1 ,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常的应用,主要考查气体摩尔体积的体积应用,氧化还原反应电子转移计算,溶液浓度的分析判断,根据是理解稀有气体是单原子分子,题目难度中等.
本题难度:简单
5、选择题 设NA为阿佛加德罗常数,下列叙述中正确的是
A.1molCH3+(碳正离子)含有电子数为10NA
B.1.8?g?重水(D2O)中含有NA个中子
C.常温常压下,48g?O3含有的氧原子数为3NA
D.标准状况下,2.24L甲苯所含的分子数为NA
参考答案:C
本题解析:分析:A、先计算一个碳正离子含有的电子数,再根据N=nNA计算总电子数.
B、先判断一个重水分子中含有的中子数,再根据N= NA计算总中子数.
NA计算总中子数.
C、根据根据N= NA结合一个臭氧分子中含有的原子数计算总原子数.
NA结合一个臭氧分子中含有的原子数计算总原子数.
D、根据气体摩尔体积的使用范围判断.
解答:A、一个碳正离子含有9个电子,所以1molCH3+(碳正离子)含有电子数为9NA,故A错误.
B、一个重水分子中含有10个中子,1.8?g?重水(D2O)的物质的量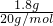 =0.09mol,所以1.8?g?重水(D2O)中含有0.9NA个中子,故B错误.
=0.09mol,所以1.8?g?重水(D2O)中含有0.9NA个中子,故B错误.
C、一个臭氧分子中含有3个O原子,48g?O3的物质的量=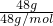 =1mol,所以48gO3含有的氧原子数为3NA,故C正确.
=1mol,所以48gO3含有的氧原子数为3NA,故C正确.
D、气体摩尔体积仅适用于气体,标况下,甲苯是液体,所以无法计算甲苯的物质的量导致无法计算甲苯含有的分子数,故D错误.
故选C
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是B,注意重水的摩尔质量是20g/mol不是18g/mol.
本题难度:简单