1、填空题 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
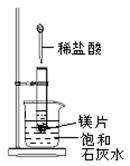
(1)(3分)实验中观察到的现象是__________________________
(2)(3分)产生上述现象的原因是_______________;
(3)(2分)写出有关的离子方程式:_______________________。
(4)(2分)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)①镁片上有大量气泡产生②镁片逐渐溶解③烧杯中溶液变混浊
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。
(3)Mg+2H+==Mg2++H2↑
(4)小于
本题解析:在金属活动顺序表中镁位于氢的前面,和酸反应能置换出氢气。金属和酸的反应一般是放热反应,所以饱和石灰水的温度要升高,但氢氧化钙的溶解度随温度的升高而降低,所以会有晶体析出。反应放热,说明反应物的总能量高于生成物的总能量。
本题难度:一般
2、选择题 影响化学反应速率的外界条件是(1)反应物颗粒大小(2)温度(3)浓度(4)使用催化剂,其中正确组合的是( )
A.全部
B.(2)(3)
C.(4)
D.(2)(3)(4)
参考答案:(1)反应物颗粒大小,接触面积大的反应速率快,故选;
(2)温度高,反应速率快,故选;
(3)浓度大,则反应速率快,故选;
(4)使用催化剂,反应速率加快,故选;
故选A.
本题解析:
本题难度:简单
3、实验题 (8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
实验编号
| 锌的状态
| 反应温度/℃
| 收集100mL氢气所需时间
|
①
| 薄片
| 15
| 200
|
②
| 薄片
| 25
| 90
|
③
| 粉末
| 25
| 10
|
(1)该实验的目的是研究 、 对锌和稀盐酸反应速率的影响。
(2)实验①和②表明 ;
(3)能表明固体的表面积对反应速率影响的实验编号是 和 。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条 。
参考答案:(1)温度和固体的接触面积(固体的形状)
(2)其它条件不变时,升高温度,化学反应速率加快; (3)②和③
(4)增加盐酸的浓度、加入少量的硫酸铜形成原电池(加入铜粉)或用粗锌
本题解析:(1)在反应中锌的固体表面积和反应的温度是不同的,所以实验的目的是研究温度和固体的接触面积对反应速率的影响的。
(2)实验①②中温度不同,温度越高,收集等条件氢气所用的时间就越少,即温度升高,反应速率加快。
(3)实验②③中温度相同,但固体的表面积是不同的。
(4)影响化学反应速率的因素除了温度和固体的接触面积之外,还可以是反应物的浓度,或者通过原电池反应来加快反应速率等。
本题难度:一般
4、选择题 下列各图中能表示A(g)+B(g) 2C(g)(正反应为放热反应)这个可逆反应的图像为
2C(g)(正反应为放热反应)这个可逆反应的图像为
A.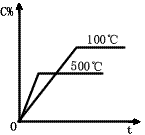
B.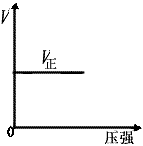
C.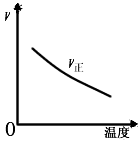
D.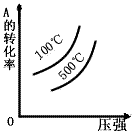
参考答案:A
本题解析:
本题难度:一般
5、选择题 把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是?
A.加入适量FeCl3溶液
B.加入适量KNO3溶液
C.加入适量的K2CO3溶液
D.加入适量Na2SO4溶液
参考答案:D
本题解析:氯化铁水解,溶液显酸性,所以生成的氢气量增加,A不正确;在酸性条件下,硝酸钾具有强氧化性,和金属反应得不到氢气,B不正确;C中的碳酸钾可以消耗氢离子,降低反应速率,但生成的氢气量减少,不正确;硫酸钠溶液相当于是稀释,反应速率降低,且生成的氢气量不变,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是要明确外界条件是如何影响反应速率的,然后结合题意灵活运用即可,有利于培养学生的应试能力和逻辑推理能力。
本题难度:一般