1、填空题 (4分)画出下列短周期元素的原子结构示意图:
(1)质量数为23,中子数为12的原子?
(2)最外层电子数是次外层电子数3倍的原子?
参考答案:略
本题解析:略
本题难度:简单
2、选择题 如图是元素周期表的一部分,下列关系正确的是

A.原子半径: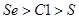
B.热稳定性: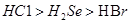
C.还原性: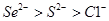
D.酸性: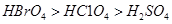
参考答案:C
本题解析:A、同周期元素原子半径随原子序数的增大而减小,所以原子半径:Se>S>Cl,错误;B、热稳定性:HCl>HBr>H2Se,错误;C、非金属性性:Se<S<Cl,所以还原性:Se2? >S2? >Cl?,正确;D、酸性:HClO4 > HBrO4,错误。
本题难度:一般
3、填空题 图表法、图像法是常用的科学研究方法。

Ⅰ.图(A)是短周期某主族元素X的电离能所示情况。则X元素位于周期表的第?族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第?族元素氢化物的沸点的变化规律。
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素o的外围电子排布式:?。
(2)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是??(填化学式),试从结构角度加以解释:?。
(3)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

请回答:晶胞中i原子的配位数为?,一个晶胞中i原子的数目为?,该晶胞的空间利用率为?。
参考答案:Ⅰ.ⅢA ⅣA
Ⅱ.(1)3d64s2
(2)SiC 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C—Si键键长比晶体Si中Si—Si键键长短,键能大,因而熔、沸点高
(3) 12?4?74%
本题解析:Ⅰ.图(A)是短周期某主族元素X的电离能所示情况。由于X的第一、第二、第三电离能相差不大,说明该元素的原子最外层有三个电子。所以X元素位于周期表的第.ⅢA。图B是研究部分元素的氢化物的沸点变化规律的图像,由于折线c表示的物质是相对分子质量越大,物质的沸点越高,符合结构相似的物质递变规律,它可以表达出第ⅣA元素氢化物的沸点的变化规律。Ⅱ.(1) o表示的是26号元素Fe。其外围电子排布式是: 3d64s2.(2)由Si原子跟C原子以1∶1相互交替结合而形成的晶体,晶体类型与晶体Si相同,都属于原子晶体。由于原子半径Si>C。原子半径越大。共价键的键长就越大,键能就越小,就越弱,断裂就容易,熔沸点更低。所以两者相比熔点更高的是SiC。(3)Al单质晶体中原子的堆积方式为面心立方堆积。在每个晶胞中与它距离相等且最近的Al原子由三个,通过每个Al原子可形成8个晶胞,由于每个Al原子都重复数了2次,所以Al原子的配位数为(3×8)÷2=12.在一个晶胞中Al原子的数目为8×1/8+6×1/2=4;假设Al原子的半径为R,则晶胞的边长L=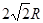 。晶胞的体积为L3=
。晶胞的体积为L3= 在一个晶胞中含有的4个Al原子的体积为
在一个晶胞中含有的4个Al原子的体积为 。所以该晶胞的空间利用率为(
。所以该晶胞的空间利用率为(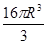 ÷
÷ )×100%=74%。
)×100%=74%。
本题难度:一般
4、选择题 1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子 的中子数与电子数之差为( )
的中子数与电子数之差为( )
A.0
B.57
C.118
D.175
参考答案:B
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知该核素的质子数=118,质量数=293。又因为中子数+质子数=质量数,核外电子数=质子数,所以该微粒中中子数与电子数之差为293-118-118=57,答案选B。
点评:该题是高考中的常见题型,试题以超铀元素为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:简单
5、填空题 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族
 周期 周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ⑦
| ?
| ⑨
| ⑧
| ?
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为________________________。
(2)②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为________________________。
 (3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的电子式:?___、?。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的电子式:?___、?。
 (4)元素④的一种氢化物A在一定条件下分解为它的另一种氢化物B,写出A的结构式_______
(4)元素④的一种氢化物A在一定条件下分解为它的另一种氢化物B,写出A的结构式_______ ?。
?。
(5)由①④⑤⑨四种元素组成的两种化合物之间可以发生反应,写出离子方程式?。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
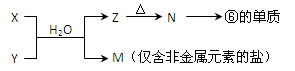
 X溶液与Y溶液反应的离子方程式为_____________________?
X溶液与Y溶液反应的离子方程式为_____________________?
 N→⑥的单质的化学方程式为_____________?_?
N→⑥的单质的化学方程式为_____________?_?
参考答案:(1)Na>Al>O? (2)H2SO4>H2CO3>H2SiO3?
?(3)  、
、 。?(4)H-O-O-H
。?(4)H-O-O-H
(5)HSO3-+H+=SO2↑+H2O? (6)Al3++3NH3·H2O=Al(OH)3↓+3NH4+? 2Al2O3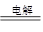 Al+3O2↑
Al+3O2↑
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑨分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。所以④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,所以②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为H2SO4>H2CO3>H2SiO3。
(3)H、O、Na形成既含离子键又含共价键的化合物是过氧化钠和氢氧化钠,电子式分别是 、
、 。
。
(4)双氧水在一定条件下能分解生成水和氧气,其结构式为H-O-O-H。
(5)由①④⑤⑨四种元素组成的两种化合物之间可以发生反应,这两种化合物是硫酸氢钠个亚硫酸氢钠,离子方程式为HSO3-+H+=SO2↑+H2O。
(6)要得到单质铝,需要通过电解熔融的氧化铝,所以N是氧化铝,则Z是氢氧化铝。所以X和Y是铝盐和氨水反应,生成氢氧化铝沉淀和铵盐。
本题难度:一般