1、选择题 下列说法正确的是
A.煤的干馏、石油的分馏都是物理变化
B.工业上常用澄清石灰水和氯气反应制漂白粉
C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析”
D.二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路”
参考答案:D
本题解析:A.煤的干馏属于化学变化;B.工业上常用石灰乳(不是澄清石灰水)和氯气反应制漂白粉;C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,前者是盐析,后者是变性;D.SiO2能够与强碱反应生成硅酸盐,因此,光导纤维二氧化硅遇强碱会“断路”。
本题难度:简单
2、选择题 化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是__________,(填化学式)。
(2)向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是__________(填序号)。
A.浓H2SO4具有脱水性
B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是______(填序号);
A.Au? B.Ag? C.Al? D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式__________________________。
(4)烧碱、纯碱溶液均可吸收CO2气体。当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温小于蒸干,称得固体质量为8g,则所得固体是____________(填化学式)。
参考答案:(1)Na2CO3(1分)
(2)A(2分)
(3)①B(2分)②Cu+H2O2+2H+=2H2O(2分)
(4)NaHCO3、Na2CO3(2分)
本题解析:(1)Na2CO3属于盐,所以不恰当。
(2)浓硫酸具有吸水性,吸收浓盐酸中的水,促进HCl的挥发,与脱水性无关,故选A项。
(3)H2O2具有氧化性,在H+存在时把Cu氧化,Cu+H2O2+2H+=2H2O
(4)若CO2与NaOH全部生成Na2CO3,质量为5.3g,若全部生成NaHCO3,质量为8.4g,实际固体产物的质量为8g,所以反应生成了Na2CO3、NaHCO3的混合物。
本题难度:一般
3、选择题 下列关于新制氯水和久置氯水的说法中,不正确的是
A.新制氯水呈黄绿色,久置氯水无色
B.新制的氯水中无氯离子,久置的氯水中含有氯离子
C.新制氯水漂白能力强,久置的氯水几乎无漂白作用
D.新制的氯水含有粒子种类多,久置氯水含有粒子种类少
参考答案:B
本题解析:次氯酸易分解,生成氯化氢和氧气,所以氯水久置后就变成了盐酸,只有酸性没有漂白性。新制的氯水中含有H+、OH-、Cl-、ClO-、Cl2、HClO、H2O等微粒,所以选项B是错误的,其余都是正确的,答案选B。
本题难度:一般
4、选择题 下列物质中,不能使品红溶液褪色的是( )
A.Cl2
B.HCl
C.SO2
D.活性炭
参考答案:A.Cl2溶于水,与水反应生成具有漂白性的HClO,可使品红褪色,故A错误;
B.HCl不具有漂白性,不可使品红褪色,故B正确;
C.SO2具有漂白性,可使品红褪色,故C错误;
D.活性炭具有吸附性,能使品红溶液褪色,故D错误;
故选:B;
本题解析:
本题难度:一般
5、选择题 将V(L) MgCl2溶液和V(L) NaCl溶液混合后,Cl-浓度为3 mol·L-1,则原MgCl2和NaCl两溶液物质的量浓度可能是
A.都是3 mol·L-1
B.分别是4 mol·L-1和1 mol-1
C.分别为1 mol·L-1和4 mol·L-1
D.都是6 mol·L-1
参考答案:C
本题解析:物质的量的浓度与体积无关,但混合时浓度与体积有关,等体积混合后,浓度为各组分浓度之和的一半.A.c(Cl-)=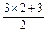 =4.5 mol·L-1不合.B项:
=4.5 mol·L-1不合.B项: =4.5 mol·L-1,不合.C.c(Cl-)=
=4.5 mol·L-1,不合.C.c(Cl-)=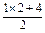 =3mol·L-1,合.D项:
=3mol·L-1,合.D项: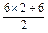 =9mol·L-1.
=9mol·L-1.
本题难度:一般