1、实验题 单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
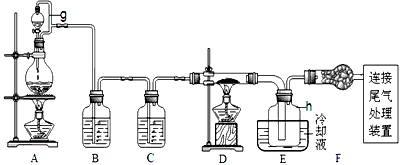
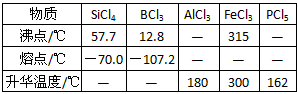
相关信息如下:①四氯化硅遇水极易水解; ②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;③有关物质的物理常数见下表
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____________________。
(2)装置A中g管的作用是____________________;装置C中的试剂是____________________;装置E中的h瓶需要冷却的理由是____________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是__________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?____(填“是”或“否”),请说明理由____________________。
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_____________。
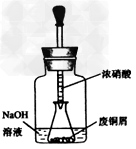
2、实验题 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: ?
步骤一:废铜屑制硝酸铜 ?
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。 ?
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4?mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。 ?
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式。________________________
(2)上图装置中NaOH溶液的作用是__________。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。
(3)步骤二中,水浴加热所需仪器有_______、_______(加热、夹持仪器、石棉网除外);洗涤的目的是____________。
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
________________________________
(5)影响产品产量的主要因素有____________。
(6)若实验得到2.42?g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80?g固体,此样品中碱式碳酸铜的质量分数是____。
3、实验题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】方法:按照下图进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。

(1)最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:____________________________ 。
【探究思考】实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(2)甲同学查阅资料后,得到Fe(OH)2如下信息:?

阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(3)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(4)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。___________________________________ 。
4、实验题 某化工厂排放的污水中含有Al3+、Hg2+、 Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下:
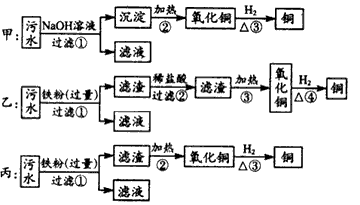
(1)以上实验方案能否得到铜:甲____, 乙____,丙____。(填“能”或“不能”)
(2)在制得铜的方案中会导致环境污染的一步操作是___,其原因是___。
(3)在可制得铜的方案中,主要的离子方程式是______。
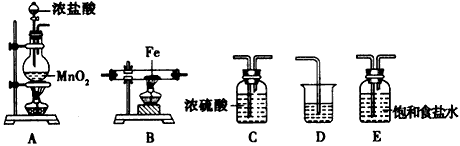
5、实验题 某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
请回答下列问题:
(1)装置A中发生反应的化学方程式为________________。
(2)各装置的正确连接顺序为(填写装置代号)A→ _____→____→____→D。
(3)装置C的作用是________________,写出装置D中反应的离子方程式:____________________。
(4)反应开始后,装置B中硬质玻璃管内的现象为____________________;可以检验生成物中是否含有
Fe3+的试剂是________。
(5)该小组欲用如图所示装置收集尾气,并测量多余气体的体积。
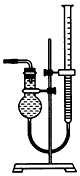
①若如图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是______ (填“酸式”或“碱式”)滴定管。
②为了提高测量的准确性,如图装置中的液体可用___________________,收集完气体后,读数前应进行的操作是____________________。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积______ (填“偏大”、“偏小”或“无影响”)。