1、选择题 决定元素种类的是(?)
A.质子数
B.电子数
C.中子数
D.质子数和中子数
参考答案:A
本题解析:略
本题难度:简单
2、选择题 短周期元素X 、Y、Z在周期表中的位置如图所示,则下列说法正确的是?(?)
、Y、Z在周期表中的位置如图所示,则下列说法正确的是?(?)
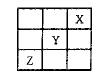
A.Z一定是活泼的金属
B.Y元素与第IA族的元素只能形成离子化合物
C.X、Y、Z三种元素中X元素的得电子能力最强
D.Z的最高价氧化物的水化物是强酸
参考答案:D
本题解析:略
本题难度:简单
3、填空题 已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有?种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
解释表中氟化物熔点差异的原因:?。
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是?。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式?。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为?。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于?晶体。
(5)F晶体的堆积方式是?(填堆积名称),其配位数为?。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式?根据价层电子对互斥理论,预测SO42-的空间构型为?。
参考答案:(1)5(1分)
(2)NaF和MgF2为离子晶体,SiF4为分子晶体,(1分) MgF2的晶格能大于NaF(1分) (3)SP3(1分)? SOCl2 + H2O = SO2↑+ 2HCl↑(2分)
(4)4s2p1(1分),原子(1分)
(5)面心立方最密堆积(1分),? 12(1分), Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+(2分)Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O + 2OH-(或将NH3·H2O写成NH3)(2分),?正四面体(1分)
本题解析:A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色是Na;工业常用电解B的熔融的氯化物来制备B,是Mg;C是一种能被HF和NaOH溶液溶解的单质,是Si;D的电负性比磷大,第一电离能却比磷小,是S;E单质是制备漂白液的原料,为Cl;F能形成红色(或砖红色)和黑色的两种氧化物,为Cu;G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有1s1,2s22p2或2s22p4,3s23p3,3d64s2(注意根据洪特规则3d44s2是3d54s1),共5种。
(2)元素Na、Mg、Si分别与氟气化合形成物质X(NaF)、Y(MgF2)、Z(SiF4)熔点NaF和MgF2为离子晶体,SiF4为分子晶体,MgF2的晶格能大于NaF。
(3)已知常温条件下,极性分子SOCl2是一种液态化合物,中心原子S有价层电子4对,杂化方式是SP3。向盛有10mL水的锥形瓶中滴加少量的SOCl2溶液,生成两种有刺激性气味的气体为水解,即SO2和HCl。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。物质分子式是GN,G为+3价,在Cu之后,故是G原子的价电子排布式为4s2p1。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于原子晶体。
(5)Cu晶体的堆积方式是面心立方最密堆积,其配位数为12。 向CuSO4溶液中滴加氨水直至过量,Cu2+先生成Cu(OH)2沉淀,在溶解为[Cu(NH3)4]2+,根据价层电子对互斥理论,SO42-的价层电子为4对,空间构型为正四面体。
本题难度:一般
4、填空题 X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+只含有一个质子;Y的最高正化合价、最低负化合价绝对值相等,在同族元素中其氢化物最稳定;Z的原子核内质子数是Y的最外层电子数的2倍;F与Z同主族;E与X同主族。试推断
(1)下列元素分别是:Y__________、Z____________、F__________。(用元素符号表示)
(2)其中原子半径最大的元素是 ,原子半径最小的元素是 .(填元素符号)
(3)X、Z、E形成化合物的电子式为________,所含有的化学键有________;它属于________化合物(填“离子”或“共价”)。
参考答案:(1)C、O、S 、(每空1分)(2)Na ; H ?(每空1分)
(3)  (2分)离子键、极性共价键(2分) 离子 (1分)
(2分)离子键、极性共价键(2分) 离子 (1分)
本题解析:X+只含有一个质子,属所以X是H元素。Y的最高正化合价、最低负化合价绝对值相等,在同族元素中其氢化物最稳定,则X应该是第ⅣA族元素的碳元素;Z的原子核内质子数是Y的最外层电子数的2倍,则Z是氧元素。F与Z同主族,则F是S元素。E与X同主族,且E的原子序数大于氧元素的,而小于S元素的,因此E是Na元素。
点评:该题是高考中的常见考点,属于基础性试题的考查。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
本题难度:一般
5、选择题 已知核电荷数均小于18的X、Y、Z、W四种元素原子的电子层数相同,而原子半径依次增大,则下列物质中酸性最强的是
A.HXO4
B.H2YO4
C.H3ZO4
D.H4WO4
参考答案:A
本题解析:电子层数相同,说明位于同一周期。同周期自左向右原子半径逐渐减小,非金属性逐渐增强。因为原子半径依次增大,则所以非金属性强弱顺序是X>Y>Z>W。非金属性越强,最高价氧化物的水化物的酸性越强,答案选A。
本题难度:一般