1、选择题 下列电子排布式属于基态原子的电子排布式的是
A.1s22s12p1
B.1s22s22p3
C.1s22s22p63p1
D.1s12s1
参考答案:B
本题解析:A、C、D均不符合能量最低原理,正确的应是1s22s2、C. 1s22s22p63s1、1s2。所以答案是B。
本题难度:一般
2、选择题 有科学家认为,随着文明的发展和社会的进步,人类有可能合成出或者从其他星球上发现
原子序数较大的元素,若发现或研制出第175号元素。试根据元素周期表知识推测,这种元素可能存在的位置是(已知:①第n周期最多容纳的元素种数为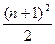 或
或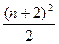 ,n=1,2,3……;②各周期中元素的种类数都是偶数)(? )
,n=1,2,3……;②各周期中元素的种类数都是偶数)(? )
A.ⅡB族
B.第八周期
C.第九周期
D.ⅥA族
参考答案:C
本题解析:根据元素周期表可知,前七周期元素种类总数为2+8+8+18+18+32+32=118,也可由题给公式进行计算:
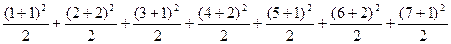 =2+8+8+18+18+32+32=118,
=2+8+8+18+18+32+32=118,
第8周期元素种数为 =50,第九周期的元素种数为
=50,第九周期的元素种数为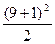 =50。故175号元素应在第九周期,B错误;而第九周期中零族元素的原子序数为218,故ⅡB族及ⅥA族的原子序数应分别为212和216,故A、D项不正确,只能选C。
=50。故175号元素应在第九周期,B错误;而第九周期中零族元素的原子序数为218,故ⅡB族及ⅥA族的原子序数应分别为212和216,故A、D项不正确,只能选C。
本题难度:简单
3、填空题 A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为?,以下三种说法中,可以验证C和E非金属性强弱的是?。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为?。
(3)盐M中含有的化学键类型有?,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的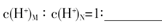
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式?,用离子方程式表示该反应生成的盐溶液显碱性的原因?
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式?。
参考答案:(1)第二周期ⅥA族,bc;(2)N>O>Na;(3)离子键、共价键;10—4;
(4)2Al + 2OH- + 2H2O=2AlO2- + 3H2↑,AlO2- + 2H2O  ?Al(OH)3 + OH-;
?Al(OH)3 + OH-;
(5)2Na2O2(s)+2H2O(g)=4NaOH(aq)+O2(g)△H=—2QkJ/mol。
本题解析:根据题意知,A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐M,则B为N,M为硝酸铵;E元素原子的最外层电子数比次外层电子数少2,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,则C为O。(1)C为O,E为S,氧与硫同主族,从上到下非金属性在减弱,则非金属性较强的元素为O,在周期表中的位置为第二周期ⅥA族,以下三种说法中,可以验证C和E非金属性强弱的是a.元素的非金属性强弱与单质的沸点高低无关,错误;b.二者形成的化合物中,氧元素显负价,说明氧元素的得电子能力比硫强,氧元素的非金属性比硫强,正确;c.元素的气态氢化物的稳定性越强,元素的非金属性越强,正确,选bc;(2)B为N,C为O,D为Na,根据同周期元素由左向右元素的第一电离能呈递增趋势,但氮原子最外层p轨道为半充满状态,较稳定,第一电离能:N>O;Na为活泼金属,第一电离能最小,三种元素的第一电离能由大到小的顺序为N>O>Na;(3)盐M为硝酸铵,含有的化学键类型有离子键、共价键;硝酸溶液中分析水的电离,计算其中氢氧根的浓度,硝酸铵溶液中的氢离子全部来自水的电离,常温下,两种溶液的pH均等于5,则由水电离出的氢离子浓度分别为10—9mol/L、10—5mol/L,c(H+)HNO3:c(H+)NH4NO3=1:10—4;(4)氢氧化钠溶液与单质铝反应生产偏铝酸钠和氢气,离子方程式为2Al + 2OH- + 2H2O=2AlO2- + 3H2↑,用离子方程式表示该反应生成的盐溶液显碱性的原因AlO2- + 2H2O  ?Al(OH)3 + OH-; (5)O和Na按原子个数比1:1形成一种离子化合物过氧化钠,根据题给信息写出过氧化钠与水反应的热化学反应方程式为
?Al(OH)3 + OH-; (5)O和Na按原子个数比1:1形成一种离子化合物过氧化钠,根据题给信息写出过氧化钠与水反应的热化学反应方程式为
2Na2O2(s)+2H2O(g)=4NaOH(aq)+O2(g)△H=—2QkJ/mol。
本题难度:一般
4、选择题 元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈
D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
参考答案:C
本题解析:同一主族,随着原子序数递增,非金属性逐渐减弱,气态氢化物的热稳定性逐渐减弱,气态氢化物的还原性逐渐增强,A项正确;同一周期从左到右元素非金属性逐渐增强,则B项正确;根据金属活动性顺序表知Ca比Na的金属性更强,所以和水反应更剧烈,C项错误。
本题难度:一般
5、选择题 短周期Y元素的p轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是
A.H3YO4
B.H4YO4
C.HYO2
D.H2YO4
参考答案:A
本题解析:短周期Y元素的p轨道上有3个未成对电子,则该元素位于周期表的ⅤA族,最高价是+价,因此该元素的最高价氧化物的水化物的化学式可能是H3YO4,A正确;B、C和D中Y元素的化合价分别是+4价、+3价和+6价,均不正确,答案选A。
本题难度:一般