1、选择题 为了检验某FeCl2溶液是否变质,可向溶液中加入
A.稀盐酸
B.浓硫酸
C.KSCN溶液
D.酚酞溶液
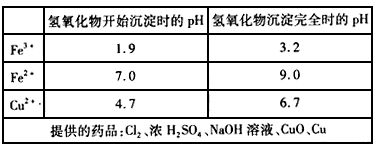
2、实验题 FeCl3常用作印刷电路铜板腐蚀剂。腐蚀铜板后的混合溶液中,若Cu2+ 、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和 Fe2+的实验步骤___________。
3、选择题 下列操作正确的是(?)
A.蒸发操作时,应使混合物中的水分完全蒸干才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶底部
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作是,所选择的萃取剂的密度必须比水大
4、填空题 (12分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。

(1)滴定:①用?式滴定管盛装camol/L盐酸标准液。右图?
表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的
标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积?
25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
指示剂
| 石蕊
| 甲基橙
| 酚酞
|
变色范围(pH)
| 5.0—8.0
| 3.1—4.4
| 8.2—10.0
|
该实验可选用 ?作指示剂;
③有关数据记录如下:
滴定序号
| 待测液体积(mL)
| 所消耗盐酸标准液的体积(mL)
|
滴定前
| 滴定后
| 消耗的体积
|
1
| V
| 0.50
| 25.12
| 24.62
|
2
|  V V
| ?
| ?
| ?
|
3
| V
| 6.00
| 30.58
| 24.58
|
?
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
?cb= ?。
(3)下列几种情况会使测定结果偏高的是?
a.若滴定前用蒸馏水冲洗锥形瓶;
b.读数时,若滴定前仰视,滴定后俯视;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
5、填空题 NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 ?。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是?
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。