1、选择题 改变下列条件一定能加快反应速率的是( )
A.增大反应物的量
B.升高温度
C.增大压强
D.减小生成物的量
参考答案:A.增加反应物的物质的量,反应物的浓度不一定变化,如固体、纯液体,反应速率不一定加快,故A错误;
B.升高温度,增加单位体积内的活化分子数,有效碰撞增加,反应速率加快,故B正确;
C.增大压强对有气体参加的反应,反应速率加快,若没有气体参加,压强对反应速率不影响,故C错误;
D.减小生成物的量,若生成物为纯固体或液体,则浓度可能不变,可能减小,反应速率不会加快,故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 下列肯定能使化学反应速率增大的措施是
[? ]
A.增加反应物的量
B.增大压强
C.升高温度
D.使用催化剂
参考答案:C
本题解析:
本题难度:一般
3、选择题 在温度相同,压强分别为p1和p2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是(?)
nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是(?)
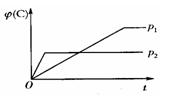
A.p1>p2 ,n<3
B.p1<p2 ,n>3
C.p1>p2 ,n>3
D.p1<p2 ,n<3
参考答案:B
本题解析:略
本题难度:简单
4、选择题 足量的锌粉和一定体积6mol?L-1的盐酸反应,当向其中加入少量的下列物质时,能够减慢反应速率,又不影响产生H2总量的是( )
A.水
B.铜粉
C.CH3COONa
D.NaOH
参考答案:A.加入水,氢离子浓度降低,反应速率减小,氢离子的总物质的量不变,则生成氢气的总量不变,故A正确;
B.加入铜粉,形成原电池反应,反应速率增大,故B错误;
C.CH3COONa,生成弱电解质,氢离子浓度降低,反应速率减小,醋酸进一步电离,可完全反应,生成氢气的总量不变,故C正确;
D.加入氢氧化钠,氢离子浓度减小,且总量减小,生成氢气的总量减小,故D错误.
故选:AC.
本题解析:
本题难度:一般
5、选择题 下列实验中,能够达到预期目的是( )
| 编号 | 实验内容 | 实验目的
A
在Na2SO3溶液中加入HNO3酸化的Ba(NO3)2,产生白色沉淀
检验Na2SO3是否变质
B
将某气体通入品红溶液中,品红褪色
证明该气体是SO2
C
用洁净的玻璃棒蘸取NaOH溶液,点在湿润的pH试纸上,与标准比色卡对照
测定NaOH溶液的pH
D
在两支试管中各加入4mL?0.01mol/L的KMnO4酸性溶液,再分别加入0.1mol/L?H2C2O4溶液2mL、0.2mol/L?H2C2O4溶液2mL,分别记录溶液褪色所需时间
探究相同条件下,溶液浓度对反应速率的影响
|
A.A
B.B
C.C
D.D
参考答案:A、亚硫酸钠具有还原性,易被氧化为硫酸钠,如果在Na2SO3溶液中加入HNO3酸化的Ba(NO3)2,则硝酸会将亚硫酸根氧化为硫酸根离子,产生硫酸钡白色沉淀,就是亚硫酸钠未变质也会发生此反应现象,故A错误;
B、二氧化硫能使品红褪色,此外强氧化性的物质都可以使品红溶液褪色,能使品红褪色的气体可以是二氧化硫还可以是氯气,故B错误;
C、氢氧化钠具有腐蚀性,不能用pH试纸来检验其酸碱性,会将pH试纸腐蚀,故C错误;
D、不同浓度的草酸和相等浓度的高锰酸钾反应,草酸浓度越大反应速率越快,这样可以探究相同条件下,溶液浓度对反应速率的影响,故D正确.
故选D.
本题解析:
本题难度:一般