1、选择题 把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示。下列因素中,影响反应速率的因素是

[? ]
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①②③
B.③④
C.①④
D.②③
参考答案:A
本题解析:
本题难度:一般
2、填空题 某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白:
(1)实验用品:具支试管、量筒、镊子、乳胶管、玻璃导管、水槽、温度计、单孔橡皮塞;稀盐酸(4mol/L)、铝片、铝粒、铝粉、水
(2)实验装置(图中铁架台等夹持仪器略去)
(3)实验方法
①按如图所示连接好实验仪器,检查装置的气密性.
②在试管中加入2mL稀盐酸.测量试管中溶液的温度.
③为防止铝刚加入试管时产生的气体逸出,实验中最好选取______(填铝片、铝粒、铝粉),具体的操作方法是______.
④收集并测量产生的气体体积并记录对应的时间.
(4)数据处理及问题讨论
①观察温度计读数的变化可知该反应是______(填吸热反应或放热反应),由______能转化______能.
②实验结束后,小组成员将产生氢气的体积与时间作了如右图.
③在OE、EF、FG段中所收集气体最多的是______段,表示化学反应速率最快的是______段.影响EF段速率变化主要因素是______;影响FG段速率变化主要因素是______.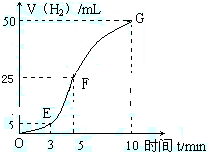
参考答案:(3)③固体反应物表面积越大反应速率越快,为了减小反应速率所以选铝粒;操作方法是:先加铝粒,然后先扭开导气管活塞,再将稀盐酸从球形漏斗中加入至浸没铝粒为止,关闭活塞待用.
故答案为:铝粒;先加铝粒,然后先扭开导气管活塞,再将稀盐酸从球形漏斗中加入至浸没铝粒为止,关闭活塞待用.
(4)①根据温度变化知,该反应是放热反应,化学能转变成热能.
故答案为:放热反应;化学能转变成热能.
③根据纵坐标的高低判断收集气体的多少,纵坐标越高,收集的气体越大,所以是FG段;
根据图象斜率判断反应速率的大小,斜率越大,反应速率越快,所以是EF段;
影响EF段速率变化主要因素是:该反应是放热反应,温度越高,反应速率越快,所以温度的改变是改变反应速率的主要原因;
影响FG段速率变化主要因素是:随着反应的进行,盐酸的浓度逐渐减小,浓度越小,反应速率越小,所以浓度的改变是改变反应速率的主要原因;
故答案为:FG段;EF段;该反应是放热反应,温度升高,反应速率加快;随着反应的进行,盐酸的浓度逐渐减小,反应速率逐渐减小.
本题解析:
本题难度:一般
3、实验题 (12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
①分别取等体积的2 mol/L
硫酸于试管中;
②分别投入大小、 形状相同 形状相同
的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
|
?
该同学的实验目的是研究?? ??对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
??对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 ?条件相同。
?条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
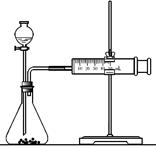
完成该实验应选用的实验药品是?
?;应该测定的实验数据是?。
参考答案:(共12分)
(1)反应物本身的性质;温度;(每空2分)
(2)Mg(或Fe)、0.5mol/L硫酸和2mol/L硫酸;(6分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
本题解析:略
本题难度:一般
4、选择题 如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是:
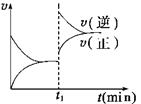
A.2A(g) + B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.2SO2(g)+ O2(g)  2SO3(g)ΔH<0
2SO3(g)ΔH<0
C.H2(g) + I2(g)  2HI(g)ΔH>0
2HI(g)ΔH>0
D.4NH3(g)+ 5O2(g)  4NO(g) + 6H2O(g)ΔH<0
4NO(g) + 6H2O(g)ΔH<0