1、选择题 pH值相等、体积相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌全部溶解且放出的气体一样多,为此下列说法正确的是:
A.反应开始时的速率:甲<乙
B.反应所需的时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙
D.反应结束时,pH值:甲<乙
2、计算题 (6分)2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(1)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为?。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是?。
(3)保持同一反应温度,在相同的容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡?移动。(填“正向、不、逆向或无法确定是否)
3、填空题 (6分)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质
| H2
| CO
| CH3OH
|
浓度/(mol·L-1)
| 0.2
| 0.1
| 0.4
|
⑴比较此时正、逆反应速率的大小:v正?v逆(填“>”、“<”或“=”)。
⑵若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =?mol·(L·min)-1。
⑶生产过程中,合成气要进行循环,其目的是?。
4、选择题 下列情况,与溶解平衡移动无关的是
A.夏天,打开冰镇啤酒瓶,立即冒出大量泡沫
B.实验室中,配制FeSO4溶液所用的蒸馏水,可用加热的方法除去溶解氧
C.侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既洒NaCl固体又通入足量NH3
D.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好
5、填空题 (4分)将4 mol SO3气和4 molNO置于2L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):?2SO3(g) 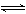 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2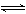 2NO2?
2NO2?
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)="0.1" mol、n(NO2)="3.6" mol,则此时SO3气的物质的量为 ?。?
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和?,或NO和?(填它们的分子式)。