1、选择题 u常见化合价有+4和+6,硝酸铀酰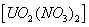 加热可发生如下分解:
加热可发生如下分解:
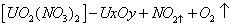 (未配平),将气体产物收集于试管中并倒扣于盛)水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是
(未配平),将气体产物收集于试管中并倒扣于盛)水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是
A.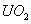
B.
C.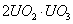
D.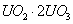
参考答案:B
本题解析:NO2和氧气溶于水,气体全部被吸收,水充满试管,这说明恰好生成硝酸。则在该分解反应中氮原子得到的电子全部来自于氧原子失去的电子,因此U的化合价是不变的,根据化学式可知,U的化合价是+6价,所以生成的铀的氧化物化学式是UO3,答案选B。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和逆向思维能力。该题的关键是利用好氧化还原反应中电子的得失守恒。
本题难度:一般
2、选择题 汽车安全气囊是汽车安全性辅助配置之一。汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 +2KNO3 ==K2O+5Na2O+16N2↑,则下列判断不正确的是
A.NaN3是还原剂
B.N2既是氧化产物又是还原产物
C.氧化产物与还原产物物质的量之比为1:15
D.标准状况下,当有10mol电子转移时生成358.4L N2
参考答案:C
本题解析:由方程式可看出A.NaN3中氮元素的化合价升高,失去电子,所以NaN3是还原剂。正确。B.NaN3中氮元素的化合价升高,失去电子,生成氧化产物N2。KNO3 的氮得到电子产生还原产物N2。故N2既是氧化产物又是还原产物。正确。C.根据上述分析可知:氧化产物N215mol;还原产物1mol..氧化产物与还原产物物质的量之比为15:1.错误。在上述反应中转移电子10mol,生成氮气16mol,在标准状况下其体积为:16mol×22.4mol∕L="358.4L" 。正确。
本题难度:一般
3、计算题 (10分)用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
aCuFeS2 + bSiO2 + cO2 → dCu +e FeSiO3 + fSO2
(1)配平上述化学反应方程式:a =___?b=___?c=___?d=___?e=___?f=___?
(2)若2.5吨黄铜矿(含CuFeS280%)发生上述反应,计算生成的SO2在标准状况下的体积(m3)。
(3)若将标准状况下的SO2 280mL通入100mL碘水中充分吸收后,多余的碘用0.182mol/LNa2S2O3溶液滴定(I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6),用去Na2S2O3溶液5.50mL。写出SO2通入碘水中反应的离子方程式。
(4)计算(3)中碘水的物质的量浓度。
参考答案:(1)? 225224(2分)
(2)? 2.5×106g×80%÷184g/mol×2×22.4×10-3m3/mol = 487m3(3分)(无过程不得分,)
(3)? SO2 + I2 +2H2O = 4H+ + SO42- +2I-(2分)
(4)? (0.182mol/L×5.50×10-3L×1/2+0.280L÷22.4L/mol)÷0.100L = 0.130mol/L
(3分,无过程不得分,答案为0.13mol/L扣1分)
本题解析:(1)根据方程式可知,铜元素的化合价从+2价降低到0价,得到2个电子,而氧气在反应中得到4个电子。S元素的化合价从-2价升高到+4价,失去6个电子,所以根据电子的得失守恒和原子守恒可知,配平后的化学计量数依次是2、2、5、2、2、4。
(2)2.5吨黄铜矿中含有CuFeS2的质量是2.5×106g×80%=2.0×106g,所以根据反应的方程式可知,生成的SO2在标准状况下的体积是2.0×106g÷184g/mol×2×22.4×10-3m3/mol = 487m3。
(3)单质碘具有氧化性,能把SO2氧化生成硫酸,反应的方程式是SO2 + I2 +2H2O = 4H+ + SO42- +2I-。
(4)根据反应式I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6可知,剩余的单质碘是0.182mol/L×5.50×10-3L×1/2=5.005×10-4mol。而根据反应式SO2 + I2 +2H2O = 4H+ + SO42- +2I-可知,与SO2反应的单质碘是
0.280L÷22.4L/mol=0.0125mol,所以碘水的浓度是(5.005×10-4mol+0.0125mol)÷0.100L = 0.130mol/L。
本题难度:一般
4、填空题 Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是?。?
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有??mol电子发生转移。?
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2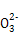 +I2
+I2 S4
S4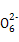 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是?mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I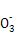 +5S
+5S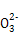 +2H+
+2H+ I2+5S
I2+5S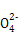 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
?
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL
| 0.01 mol/LNa2SO3溶液的体积/mL
| H2O的体积/mL
| 实验温度/℃
| 溶液出现蓝色时所需时间/s
|
实验1
| 5
| V1
| 35
| 25
| ?
|
实验2
| 5
| 5
| 40
| 25
| ?
|
实验3
| 5
| 5
| V2
| 0
| ?
|
?
该实验的目的是?;表中V2=??mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是?。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O Ce(OH)4↓+?。
Ce(OH)4↓+?。
参考答案:(1)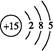
(2)20
(3)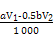 (或其他合理答案)
(或其他合理答案)
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案) 40
(5)分解出氯化氢气体,抑制CeCl3水解(或其他合理答案)
(6)2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+
2Ce(OH)4↓+6H+
本题解析:Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为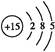 。
。
(2)P元素的化合价由+5价降到了P4中的0价,故每生成1 mol P4转移20 mol电子。
(3)根据化学方程式可知,I2的物质的量等于硫代硫酸钠的物质的量的一半加上维生素C的物质的量,则维生素C的物质的量为:(V1·a×10-3-0.5V2·b×10-3)mol。
(4)通过分析表中的数据可知,该实验研究的是温度、浓度对反应速率的影响;由于实验1和实验2的温度相同,故实验2与实验3的溶液的浓度一定相同,即水的体积一定相同,因此V2=40(mL)。
Ⅱ.(5)由于加热时氯化铵分解放出氯化氢气体,可以抑制CeCl3的
水解。
(6)分析反应可知,Ce3+化合价升高到了Ce(OH)4中的+4价,而H2O2中O的化合价由-1价降到-2价,根据电子守恒可确定Ce3+的化学计量数是2,而H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质是H+,最后根据原子守恒配平反应:2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+。
2Ce(OH)4↓+6H+。
本题难度:一般
5、选择题 (NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中,氧化产物与还原产物的物质的量之比是
A.2∶3
B.3∶2
C.4∶3
D.1∶3
参考答案:A
本题解析:首先写出反应方程式:
3(NH4)2PtCl6="=" 2N2+16HCl+2NH4Cl+3Pt,其中N2是氧化产物,Pt是还原产物,物质的量之比为2∶3,A正确。
点评:能熟练判断氧化产物和还原产物等基本概念
本题难度:一般