1、选择题 在反应3BrF3 + 5H2O = HBrO3 + Br2 +9HF + O2↑中,若有5molH2O做还原剂,被水还原的BrF3的物质的量为(?)
A.3mol
B.10/3mol
C.7.5mol
D.无法计算
参考答案:B
本题解析:略
本题难度:简单
2、选择题 中科院合肥科学岛的专家建成“多功能铅铋堆技术综合实验回路KYLIN—Ⅱ”,该装置是世界最大的多功能液态铅铋综合实验平台,液态金属材料具有高效导热、高沸点、大容量储能的特点,具有广泛的应用前景。下列说法正确的是
A.液态金属铅中含有离子健
B.20.7g铅与足量稀盐酸反应生成2.24L氢气
C.可溶性铅盐会引起中毒
D.液态金属铅是由于其中的氢键作用而形成
参考答案:C
本题解析:A.金属铅是金属晶体。在液态铅中含有金属健。错误。B.20.7g铅的物质的量20.7g÷207g/mol=0.1mol,Pb是+2价的金属,所以与足量稀盐酸反应生成氢气0.1mol,在标准状况下体积为2.24L。错误。C.Pb是重金属,不慎误服可溶性铅盐会引起中毒。正确。D.液态金属铅是由于其中的金属阳离子与自由电子之间通过金属键作用而形成。错误。
本题难度:一般
3、选择题 有关反应5Cu + 4H2SO4(浓) Cu2S + 3CuSO4 + 4H2O的叙述正确的是
Cu2S + 3CuSO4 + 4H2O的叙述正确的是
A.氧化剂与还原剂的物质的量之比为1:5
B.每有1 mol Cu参加反应时转移2 mol e-
C.氧化产物只有CuSO4
D.浓硫酸既是氧化剂又是还原剂
参考答案:A
本题解析:根据方程式可知,在反应中铜的化合价从0价部分升高到+2价,部分升高到+1价,共计失去2×3+1×2=8个电子。S元素的化合价从+6价降低到-2价,得到8个电子,则氧化剂与还原剂的物质的量之比为1:5,A正确;每有1 mol Cu参加反应时转移8mol÷5=1.6mol e-,B不正确;氧化产物是硫酸铜和硫化亚铜,C不正确;浓硫酸起氧化剂和酸性的作用,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念灵活运用即可。在进行有关计算时,要利用好电子的得失守恒。
本题难度:一般
4、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ/mol
下列说法正确的是
A.若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出热量为173.4 kJ/mol
B.由反应①可推知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H﹥-574kJ/mol
C.反应②中当4.48LCH4反应完全时转移的电子总数为1.60mol
D.反应①②转移的电子数相同
参考答案:D
本题解析:A、①+②得:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g);ΔH=-1734? kJ/mol-1,将题给数据带入计算,放出热量的数值正确单位错误,错误;B、对比①和选项所给反应生成物水的状态不同,生成液态水放出的热量多,△H越小,错误;C、反应②中没有明确温度和压强,无法计算甲烷的物质的量,无法计算转移的电子数,错误;D、反应①和②中CH4?均被氧化为CO2转移电子数为8,正确。
本题难度:一般
5、填空题 (14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4,Q、Y的氧化物是导致酸雨的主要物质,X是地壳中含量最高的金属元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。以下问题均有化学用语回答
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(3)Na2Y溶液中离子浓度由大到小的顺序为____________________________________________。
 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(5)ZCl2溶液中混有FeCl3杂质时,可加入_____________(填试剂)调节pH=_________,再过滤。已知:Fe(OH)3的Ksp=10-35,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。
(6)工业上可用高温条件下Z2Y + O2=2Z + YO2来冶炼金属Z,生成1molZ时转移____mol电子。
参考答案: (1)
(1)
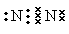 ?(1分)? S2->O2->Al3+(2分)
?(1分)? S2->O2->Al3+(2分) (2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分)
(2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分)
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (2分)
 (4)3CuO + 2NH3
(4)3CuO + 2NH3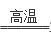 3Cu + N2 + 3H2O (2分)
3Cu + N2 + 3H2O (2分)
(5)CuO(1分) pH=4 (2分)?(6)3 (2分)
本题解析:Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。Q、Y的氧化物是导致酸雨的主要物质,则Q是氮元素,Y是硫元素。X是地壳中含量最高的金属元素,因此X是铝元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,所以Z是铜元素。W原子最外层电子数与核外电子总数之比为3∶4,且原子序数介于氮元素与铝元素之间,因此W是氧元素,则
 (1)氮气分子中含有氮氮三键,单质的电子式为
(1)氮气分子中含有氮氮三键,单质的电子式为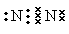 。
。 离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
 (2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。
(2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。
(3)Na2S溶液中硫离子水解,溶液显碱性,则溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
 (4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3
(4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
(5)由于除杂时不能引入新的杂质,则CuCl2溶液中混有FeCl3杂质时,可加入CuO调节pH。当溶液中铁离子浓度为1×10-5mol/L时,此时溶液中氢氧根离子浓度为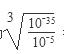 =10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
=10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
(6)根据Cu2S + O2=2Cu +SO2可知,只有硫元素的化合价从-2价升高到+4价,失去6个电子,因此生成1molZ时转移3mol电子。
本题难度:一般