1、填空题 下列反应在210℃达到平衡:
PCl5(g) PCl3(g)+Cl2(g),其△H>0,K1=1 ①
PCl3(g)+Cl2(g),其△H>0,K1=1 ①
CO(g)+Cl2(g) COCl2(g) ,其△H<0,K2=5×104 ②
COCl2(g) ,其△H<0,K2=5×104 ②
COCl2(g) CO(g)+Cl2(g),其△H>0, K3=? ③
CO(g)+Cl2(g),其△H>0, K3=? ③
(1)根据反应①的平衡常数K的表示式,下列等式必定成立的是__________。
A. c(PCl5) =c(PCl3)=c(Cl2)=1
B. c(PCl5)=c(PCl3)+c(Cl2)=1
C. c(PCl5)=c(PCl3)c(Cl2)
(2)反应②和反应③的平衡常数K表达式_______(填“相同”或“不同”);K3=_______。
(3)降低Cl2浓度,反应③的平衡常数K3值将_______(填“增大”、“减小”或“不变”)
(4)要使反应①和反应②的K值相等,应采取的措施是_______。
A.反应①和反应②同时升高温度
B.反应①和反应②同时降低温度
C.反应①降低温度,反应②维持210℃
参考答案:(1)C
(2)不同;1/K2=2×10-5
(3)不变
(4)A
本题解析:
本题难度:一般
2、填空题 氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示
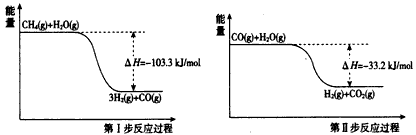
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是______________。
(2)第Ⅱ步为可逆反应。在800℃时,若CO的起始浓度为2.0mol/L,水蒸气的 起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则 此反应的平衡常数为____________,CO的平衡转化率为___________。
参考答案:(1)CH4(g)+2H2O(g)=4H2(g)+CO2(g) △H=-136.5 kJ/mol
(2)1;60%
本题解析:
本题难度:一般
3、选择题 在一固定体积的密闭容器中,有下列化学反应:CO(g)+H2O(g)?CO2(g)+H?2(g),其化学平衡常数K和温度T的关系如下表
| T(℃) | 700 | 800 | 830 | 1000 | 1200
K
0.6
0.9
1.0
1.7
2.6
|
则下列说法错误的是( )
A.其他条件不变,升高温度,CO的转化率变大
B.温度升高,正、逆反应速率都增大,在平衡移动的过程中气体压强始终保持不变
C.反应达平衡时,混合气体的平均摩尔质量M:18<M<26
D.若在某平衡状态时,c(CO2)×c(H2)=c(CO)×c(H2O),则此时的温度为830℃
参考答案:BC
本题解析:
本题难度:简单
4、简答题 下列说法正确的是( )
A.电离平衡常数受溶液浓度的影响
B.电离平衡常数可以表示弱电解质的相对强弱
C.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
D.H2CO3的电离常数表达式:K=
参考答案:A、电离平衡常数是温度的函数,与溶液浓度无关,故A错误;
B、电离平衡常数可以表示弱电解质的相对强弱,故B项正确;
C、酸中c(H+)既跟酸的电离常数有关,还跟酸的浓度有关,故C错误;
D、碳酸是分步电离的,第一电离常数表达式为:K1=C(H+)C(HCO3-)?C(H2CO3),第二步电离常数为:K2=C(H+)C(CO32-)C(HCO3-),故D错误.
故选:B.
本题解析:
本题难度:一般
5、简答题 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5
n(NO)(mol)
0.020
0.01
0.008
0.007
0.007
0.007
|
(1)已知升高温度,NO2的浓度减小,则该反应是______热反应.
(2)如图中表示NO2的变化的曲线是______
用O2表示从0~2s内该反应的平均速率v=______
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离除NO2气体?b.适当升高温度
c.增大O2的浓度?d.选择高效催化剂.
参考答案:(1)升高温度,平衡向吸热反应方向移动,NO2的浓度减小,则平衡向逆反应方向移动,所以正反应是放热反应,
故答案为:放;?
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=0.020-0.00822mol/(L.min)=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为?0.0015mol/(L?s),
故答案为:b,0.0015mol/(L?s);?
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;?
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;?
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
故选c.
本题解析:
本题难度:一般