| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《盐类水解的原理》典型例题(二)
参考答案:D 本题解析:A.明矾和FeCl3 可作净水剂依据铝离子、铁离子水解生成胶体具有较大的表面积,具有吸附悬浮杂质的作用;有关;B.加入盐酸抑制铁离子的水解,有关;C.碳酸氢根离子和铝离子发生双水解生成二氧化碳和氢氧化铝沉淀,有关;D.氢氟酸和玻璃反应,所以氢氟酸用塑料试剂瓶保存而不用玻璃试剂瓶保存,无关,选D. 本题难度:一般 2、选择题 常温下,有关下列4种溶液的说法正确的是
A.由水电离出的c(H+):③>① B.①稀释到原来的100倍,pH与②相同 C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>c(Cl-) D.②与④等体积混合,混合液pH>7 参考答案:D 本题解析:A、盐酸是强酸,氨水是弱碱,因此在浓度相同的条件下,盐酸对水的电离抑制程度大,即由水电离出的c(H+):③<①,A不正确;B、氨水是弱碱,0.1 mol·L-1氨水稀释到原来的100倍浓度是0.001mol/L,其溶液的pH值小于11,B不正确;C、①与③混合,若溶液pH=7,则根据电荷守恒可知溶液中c(NH4+)=c(Cl-),C不正确;D、②与④等体积混合后氨水过量溶液显碱性,因此混合液pH>7,D正确,答案选D。 本题难度:一般 3、选择题 下列溶液中各微粒的浓度关系不正确的是 |
参考答案:D
本题解析:0.1 mol·L-1 HCOOH溶液中质子守恒:c(HCOO-)+c(OH-)=c(H+),故A项说法正确;1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中Cu2+、NH4+、SO42—为主体,且Cu2+、NH4+水解溶液呈酸性,故离子浓度大小关系为:c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-),B项说法正确;0.1 mol·L-1 NaHSO3溶液中质子守恒:c(H+)+c(H2SO3)=c(SO32—)+c(OH-),故C项说法正确;等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中存在HX H++X—,与X—+H2O
H++X—,与X—+H2O HX+OH-,但不清楚电离平衡程度大,还是水解程度大,故不能判断c(H+)与c(OH-)的相对大小,D项错误,本题选D。
HX+OH-,但不清楚电离平衡程度大,还是水解程度大,故不能判断c(H+)与c(OH-)的相对大小,D项错误,本题选D。
考点:溶液中离子守恒关系。
本题难度:困难
4、填空题 (10分)化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。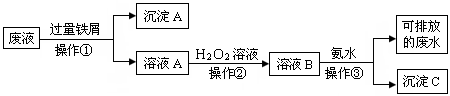
(1)操作①的名称是 。
(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是 。
(3)操作②中发生反应的离子方程式为 。
(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4·7H2O)的实验方案。
参考答案:(1)过滤 (2)溶液由浅绿色变为棕黄色,有少量气泡出现。
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + H2O
(4)在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜。滤液加热浓缩后冷却结晶,过滤,干燥得绿矾。
本题解析:(1)分离溶液和沉淀应用过滤方法(2)溶液A中含亚铁离子,过氧化氢溶液有氧化性,可将亚铁离子氧化成铁离子,铁离子为棕黄色,过氧化氢本身被还原成氧气,故有气泡冒出(3)亚铁离子被氧化,过氧化氢被还原(4)沉淀A含铁和铜,加入稀硫酸将铁转化为FeSO4,再加热浓缩后冷却结晶,过滤,干燥得绿矾。
本题难度:困难
5、填空题 (14分)(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
参考答案:(Ⅰ)(1)K1·K2(2分); >(2分)
(2)加入催化剂(2分);将容器的体积(快速)压缩至2L(2分,仅答加压的给1分)
(3)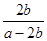 ×10-7(2分)
×10-7(2分)
(Ⅱ)(1)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2分)
(2)21%。(2分)
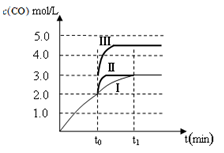
本题解析:(Ⅰ)(1)反应①的平衡常数表达式K1=[CH3OH]/[CO][H2]2,反应②的平衡常数表达式K2="[CO]" [H2O]/[CO2][H2],反应③的平衡常数表达式K3=[CH3OH] [H2O]/[CO2][H2]3,则K3= K1·K2。500℃时反应③的平衡常数K3= K1·K2=2.5,在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, Q=(0.3×0.15)÷(0.8×0.1)=0.5625,Q<K,反应正向进行,则此时V正>V逆。(2)对于反应②:在t0时刻改变一个条件,曲线Ⅰ变为曲线Ⅱ,由图像可知平衡时c(CO)不变,说明平衡没有移动,但缩短了达平衡的时间,改变的条件为加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO的平衡浓度由3.0mol/L迅速变为4.5 mol/L,反应在3 L容积可变的密闭容器中发生,且该反应两边气体物质的系数相等,则改变的条件为将容器的体积(快速)压缩至2L。(3)醋酸的电离方程式为CH3COOH  CH3COO-+H+,要计算醋酸的电离常数也就是求[CH3COOH]、[CH3COO-]和[H+],根据题给信息反应后剩余醋酸的浓度为(a-2b)/2mol/L,混合液中的电荷守恒式为2[Ba2+]+[H+]=[CH3COO-]+[OH-],又反应平衡时,反应平衡时,2c(Ba2+)= c(CH3COO-),得[CH3COO-]="b" mol/L,[H+]=[OH-]=10-7 mol/L,带入平衡常数表达式计算可得醋酸的电离常数为
CH3COO-+H+,要计算醋酸的电离常数也就是求[CH3COOH]、[CH3COO-]和[H+],根据题给信息反应后剩余醋酸的浓度为(a-2b)/2mol/L,混合液中的电荷守恒式为2[Ba2+]+[H+]=[CH3COO-]+[OH-],又反应平衡时,反应平衡时,2c(Ba2+)= c(CH3COO-),得[CH3COO-]="b" mol/L,[H+]=[OH-]=10-7 mol/L,带入平衡常数表达式计算可得醋酸的电离常数为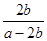 ×10-7。(Ⅱ)(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时二者反应生成草酸氢钠溶液,草酸氢钠(NaHC2O4)溶液显酸性,则草酸氢根的电离程度大于其水解程度,溶液中各种离子浓度的大小关系c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2)设25mL溶液中含xmol H2C2O4·2H2O 、ymol KHC2O4,根据酸碱中和滴定可以得出:2x+y=0.25×0.02,根据氧化还原反应判断,5C2O42———2MnO4—,可以得出:x+y=0.1×0.016×2.5,解得x=0.001mol,所以在250mL中 H2C2O4·2H2O的物质的量为0.01mol,质量为1.26g,质量分数为21%。
×10-7。(Ⅱ)(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时二者反应生成草酸氢钠溶液,草酸氢钠(NaHC2O4)溶液显酸性,则草酸氢根的电离程度大于其水解程度,溶液中各种离子浓度的大小关系c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2)设25mL溶液中含xmol H2C2O4·2H2O 、ymol KHC2O4,根据酸碱中和滴定可以得出:2x+y=0.25×0.02,根据氧化还原反应判断,5C2O42———2MnO4—,可以得出:x+y=0.1×0.016×2.5,解得x=0.001mol,所以在250mL中 H2C2O4·2H2O的物质的量为0.01mol,质量为1.26g,质量分数为21%。
考点:考查化学反应速率和化学平衡,溶液中的离子反应及相关计算。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《离子共存》.. | |