|
高考化学知识点总结《有关氧化还原反应的计算》考点预测(2019年强化版)(一)
2019-06-28 22:14:53
【 大 中 小】
|
1、填空题 某学生往一支试管里按一定次序分别加入下列几种物质:
A.KI溶液,
B.淀粉溶液,
C.NaOH溶液,
D.氯水。发现溶液颜色按下面次序变化:
| ①无色―→②棕黄色―→③蓝色―→④无色。
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是_________________________________________________。
(2)写出①→②的离子反应方程式,若为氧化还原反应,请标明电子转移的方向和总数:_______________________________________________________________________。
(3)写出③→④的化学反应方程式:___________________________________________。
2、填空题 为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
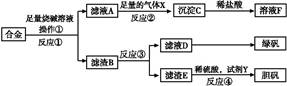
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号
| ①
| ②
| ③
| ④
| 稀硝酸体积(mL)
| 100
| 200
| 300
| 400
| 剩余金属质量(g)
| 9.0
| 4.8
| 0
| 0
| NO体积(L)
| 1.12
| 2.24
| 3.36
| V
|
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
3、选择题 加碘盐的主要成分是NaCl,还添加了适量的KIO3。下列说法中正确的是
A.KIO3和NaCl为离子化合物,均只含离子键
B.KIO3中阳离子的结构示意图为
C.23Na37Cl中质子数和中子数之比是8∶7
D.次碘酸的结构式为H—O—I
4、选择题 下列反应属于置换反应的是
A.CuO + H2 =" Cu" + H2O
B.CaCO3 =" CaO" + CO2
C.Na2O + H2O ="2" NaOH
D.Al2O3 + 6HCl = 2AlCl3 + 3H2O
5、填空题 A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题:
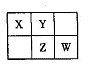
(1)W的最高价氧化物化学式是?;Z的原子结构示意图为?。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为?。
(3)AW3可用于净水,其原理是?。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是??。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)?。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式?。
|