1、实验题 某研究小组测定菠菜中草酸及草酸盐含量(以C2O42-计),实验步骤如下:
①将菠菜样 品预处理,得到含有草酸及草酸盐的溶液。
品预处理,得到含有草酸及草酸盐的溶液。
②调节溶液至弱碱性,滴加足量CaCl2溶液,产生白色沉淀,过滤得到CaC2O4固体。
③用稀HCl溶解CaC2O4配成100mL溶液,然后用KMnO4标准溶液滴定2~3次。
(1)步骤①中““样品预处理”的方法是?。
A.灼烧成灰、浸泡、过滤 ? B.研磨榨汁、浸泡、过滤
(2)步骤②中“调节溶液至弱碱性”的目的是______________________?。
(3)步骤②进行中应及时验证CaCl2溶液已“足量”,操作方法和现象是:? _。
(4)步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 ? 。
(5)本实验中滴定不需要另加指示剂,滴定终点的现象是______________________。
参考答案:(1)B (3分)
(2)将H2C2O4转化为C2O42-,否则无法转化为沉淀 (3分)
(3)静置,待上层溶液澄清后继续滴加CaCl2溶液,不再出现浑浊说明CaCl2已足量(3分)
(4)酸式滴定管、容量瓶(4分)
(5)溶液由无色变成浅紫色且半分钟内不褪色
本题解析:略
本题难度:一般
2、选择题 下列各图所示实验设计不能达到相应实验目的的是
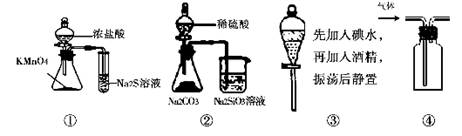
A.用图①比较KMnO4、Cl2、S的氧化性
B.用图②所示实验可比较硫、碳、硅三种元素的非金属性强弱
C.用图③所示实验从碘水中萃取碘
D.用图④所示实验装置排空气法收集CO2气体
参考答案:C
本题解析:C、碘水和酒精易溶,不分层,故错。故选C。
点评:本题主要考查了常见的实验操作,难度不大,平时注意知识的积累。
本题难度:简单
3、选择题 除去乙烷中少量乙烯的最好方法是( )
A.通过足量的溴的四氯化碳溶液
B.通过足量的溴水
C.先通过足量的酸性高锰酸钾溶液,再通过碱石灰
D.催化加氢
参考答案:A.通过足量的溴的四氯化碳溶液,乙烯与溴发生加成反应,乙烷部分溶于四氯化碳,且气体中可能混有溴蒸汽和水蒸气;
B.通过足量的溴水,可除去乙烯,但乙烷中可能混有溴蒸汽和水蒸气;
C.先通过足量的酸性高锰酸钾溶液,乙烯被氧化生成二氧化碳气体,再通过碱石灰,气体中的水、二氧化碳可被吸收,进而得到纯净的乙烷;
D.催化加氢要求高温高压条件,在实验室中难以完成,且不能确定乙烯的量的多少,易得到乙烷和氢气的混合物.
综上分析,最好的方法为C,
故选C.
本题解析:
本题难度:一般
4、实验题 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸②Na+水③Al+NaOH溶液。请回答下列问题:
(1)写出②、③反应的离子方程式②________________;③________________。
(2)在点燃H2之前必须先进行__________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是_____________。
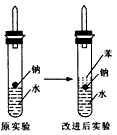
(4)实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。在改进后的实验中H2的生成速率减慢。 原因是________。改进后的实验现象为_________________________________________。
参考答案:(1)2Na+2H2O = 2Na++2OH-+H2↑;2A1+2OH-+2H2O = 2AlO2-+3H2↑
(2)检验H2的纯度
(3)大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸
(4)钠处于苯和水的交界处,钠与水反应产生的H2使钠浮起,脱离水面,反应停止,当钠表面的H2逸出,钠又回落水层,如此反复,钠间歇与水反应
本题解析:
本题难度:一般
5、简答题 高锰酸钾是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.如图是实验室制备的操作流程:

上述反应②的化学方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3
已知:
| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK
293K溶解度(g)
111
33.7
11.1
217
|
(1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是______;反应①的化学方程式为______.
(2)从滤液中得到KMnO4晶体的实验操作依次是______(选填字母代号,下同).
a.蒸馏b.蒸发c.灼烧d.抽滤e.冷却结晶
(3)制备过程中需要用到纯净的CO2气体.制取纯CO2净最好选择下列试剂中______.
a.石灰石b.浓盐酸c.稀疏酸d.纯碱
(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.原因是______.
(5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中______,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
参考答案:(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚;加热条件下,二氧化锰、氢氧化钾和氯酸钾反应生成锰酸钾、氯化钾和水,反应方程式为:3MnO2+6KOH+KClO3高温.3K2MnO4+KCl+3H2O,
故答案为:高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚,3MnO2+6KOH+KClO3高温.3K2MnO4+KCl+3H2O;
(2)从滤液中得到KMnO4晶体的实验操作是浓缩蒸发,冷却结晶,过滤或抽滤得到晶体;
故答案为:bed;
(3)若要在实验室制备较纯净的CO2,不能采用盐酸,因为有挥发性,硫酸与碳酸钙制取二氧化碳反应被生成的硫酸钙微溶物阻止反应进行不可取,所以选择碳酸钠与硫酸;
故答案为cd;
(4)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,
故答案为:KHCO3的溶解度比K2CO3小的多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出;
(5)因为盐酸具有还原性,易被高锰酸钾氧化,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时基本上都会留在母液中,硫酸加入生成的硫酸钾溶解度小,会随KMnO4一起结晶析出得到的高锰酸钾中含有杂质;
故答案为:a;
本题解析:
本题难度:一般