1、实验题 某研究小组测定菠菜中草酸及草酸盐含量(以C2O42-计),实验步骤如下:
①将菠菜样 品预处理,得到含有草酸及草酸盐的溶液。
品预处理,得到含有草酸及草酸盐的溶液。
②调节溶液至弱碱性,滴加足量CaCl2溶液,产生白色沉淀,过滤得到CaC2O4固体。
③用稀HCl溶解CaC2O4配成100mL溶液,然后用KMnO4标准溶液滴定2~3次。
(1)步骤①中““样品预处理”的方法是?。
A.灼烧成灰、浸泡、过滤 ? B.研磨榨汁、浸泡、过滤
(2)步骤②中“调节溶液至弱碱性”的目的是______________________?。
(3)步骤②进行中应及时验证CaCl2溶液已“足量”,操作方法和现象是:? _。
(4)步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 ? 。
(5)本实验中滴定不需要另加指示剂,滴定终点的现象是______________________。
2、选择题 下列各图所示实验设计不能达到相应实验目的的是
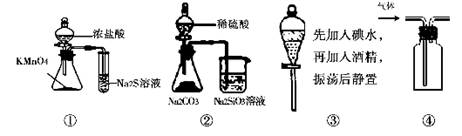
A.用图①比较KMnO4、Cl2、S的氧化性
B.用图②所示实验可比较硫、碳、硅三种元素的非金属性强弱
C.用图③所示实验从碘水中萃取碘
D.用图④所示实验装置排空气法收集CO2气体
3、选择题 除去乙烷中少量乙烯的最好方法是( )
A.通过足量的溴的四氯化碳溶液
B.通过足量的溴水
C.先通过足量的酸性高锰酸钾溶液,再通过碱石灰
D.催化加氢
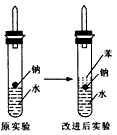
4、实验题 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸②Na+水③Al+NaOH溶液。请回答下列问题:
(1)写出②、③反应的离子方程式②________________;③________________。
(2)在点燃H2之前必须先进行__________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是_____________。
(4)实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。在改进后的实验中H2的生成速率减慢。 原因是________。改进后的实验现象为_________________________________________。
5、简答题 高锰酸钾是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.如图是实验室制备的操作流程:

上述反应②的化学方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3
已知:
| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK
293K溶解度(g)
111
33.7
11.1
217
|
(1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是______;反应①的化学方程式为______.
(2)从滤液中得到KMnO4晶体的实验操作依次是______(选填字母代号,下同).
a.蒸馏b.蒸发c.灼烧d.抽滤e.冷却结晶
(3)制备过程中需要用到纯净的CO2气体.制取纯CO2净最好选择下列试剂中______.
a.石灰石b.浓盐酸c.稀疏酸d.纯碱
(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.原因是______.
(5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中______,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.